Biomimetische Moleküle zur Programmierung der Zellmechanik
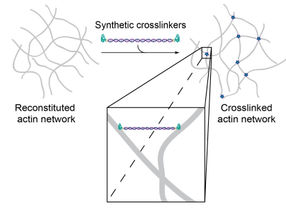
Forscher des Fraunhofer-Instituts für Zelltherapie und Immunologie und der Universität Leipzig entwickeln System zur präzisen Erforschung und Modulierung mechanischer Eigenschaften von Zellen. Durch synthetische Crosslinker-Moleküle kann die Quervernetzung zellulärer Stützproteine (Aktin) gezielt gesteuert und deren Bindungseigenschaften isoliert untersucht werden.
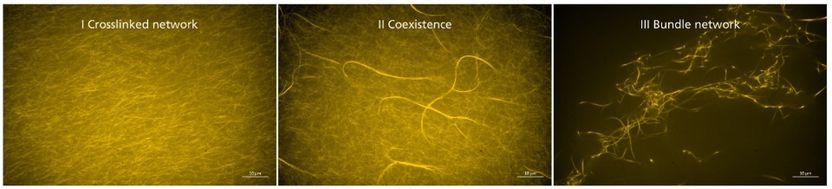
Synthetische Crosslinker beeinflussen konzentrationsabhängig die Morphologie von Aktinnetzwerken und somit deren Elastizität. Fluoreszenzmikroskopie.
© Foto Source: Synthetic Transient Crosslinks Program the Mechanics of Soft, Biopolymer-Based Materials, J. Lorenz et al., Advanced Materials, Copyright © 2018, Wiley-VCH | Figure 3/c
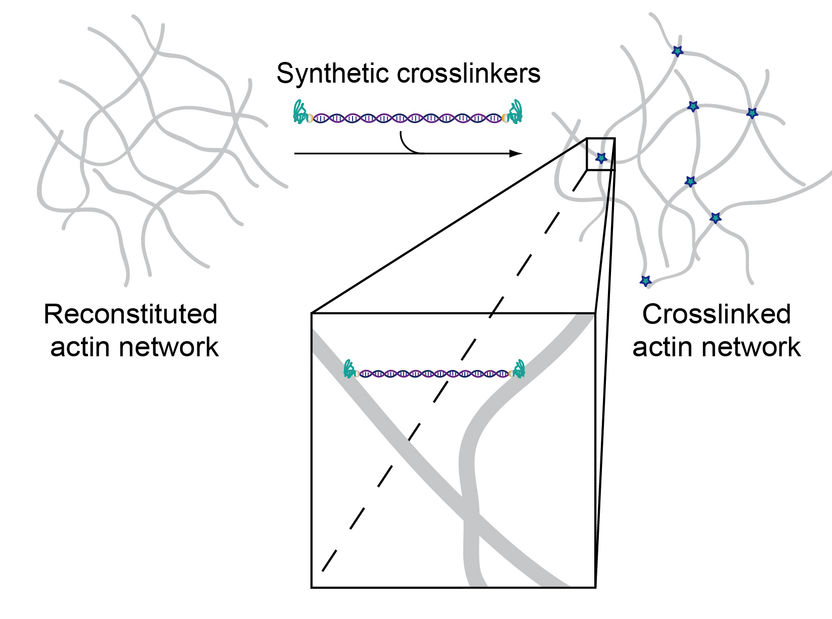
Zwei Aktin-bindende Peptide sind durch einen DNA-Doppelstrang miteinander verbunden, wodurch die Quervernetzung von Aktinfilamenten ermöglicht wird.
© Foto Source: Synthetic Transient Crosslinks Program the Mechanics of Soft, Biopolymer-Based Materials, J. Lorenz et al., Advanced Materials, Copyright © 2018, Wiley-VCH | Figure 1/b

Zellen sind die kleinsten lebenden Einheiten aller Organismen. Neben verschiedensten biochemischen Prozessen spielen auch die biophysikalischen Eigenschaften eine wichtige Rolle für deren Funktionalität. Die mechanischen Eigenschaften des Zytoskelettes beispielsweise sind für die Festigkeit, Verformbarkeit und Elastizität von Zellen maßgebend. Zudem ermöglicht das Zytoskelett aktive Zellbewegungen und den Transport von Molekülen innerhalb der Zelle. Diese scheinbar gegensätzlichen Funktionalitäten werden durch ein dynamisches Arrangement von Aktinfilamenten und deren Interaktion mit speziellen Proteinen, sogenannten Aktin Crosslinkern, erreicht. Diese natürlich vorkommenden Proteine sind in der Lage Aktinfilamente transient zu verknüpfen und beeinflussen dadurch u.a. die mechanischen Eigenschaften der Zelle.
Zellen verfügen über ein Repertoire an verschiedenen Crosslinkern, die sich in ihren molekularen Eigenschaften stark unterscheiden. Sowohl die Zusammensetzung als auch die Interaktionen der verschiedenen Crosslinker-Moleküle mit Aktinstrukturen haben Einfluss auf die Zellmechanik. Spezifische Eigenschaften dieser Crosslinker und deren Einfluss auf die Zellmechanik lassen sich jedoch nur schwer entkoppelt voneinander untersuchen. Daher waren Studien zur präzisen Charakterisierung einzelner Crosslinker-Moleküle und deren Auswirkungen auf das Gesamtsystem bisher kaum umsetzbar. Wissenschaftlern des Fraunhofer IZI und der Universität Leipzig ist es nun gelungen natürlich vorkommende Aktin-Crosslinker synthetisch nachzubilden. Diese können in einzelnen Eigenschaften gezielt modifiziert und untersucht werden.
Die künstlichen Crosslinker bestehen aus einem doppelsträngigen DNA-Abschnitt an dessen Enden jeweils ein Aktin-bindendes Peptid gekoppelt ist. Durch den Austausch der Peptide kann nun die Bindungsaffinität zu Aktin modifiziert werden, ohne dabei andere Parameter wie Moleküllänge, Flexibilität oder Anzahl der Bindungsdomänen zu verändern. Dies ermöglicht präzise Untersuchungen der Bindungseigenschaften in Abhängigkeit von der Konzentration der Crosslinker. Die Forscher konnten zeigen, dass die künstlich hergestellten Moleküle sehr spezifische mechanische Eigenschaften ihrer natürlichen Vorbilder induzieren, sich jedoch deutlich einfacher synthetisieren und modifizieren lassen.
In ihren Versuchen außerhalb von Zellen konnten die Wissenschaftler nachweisen, dass die synthetischen Crosslinker sowohl die Steifigkeit als auch die Morphologie von Aktinnetzwerken konzentrationsabhängig beeinflussen. Die Anzahl und Vernetzung der Aktin-Bündel korreliert dabei mit der Steifigkeit des Netzwerks. Eingebaute Schnittstellen in den DNA-Abschnitten der Crosslinker ermöglichten es den Wissenschaftlern zusätzlich, diesen Vorgang schaltbar und reversibel zu gestalten und somit den Grad der Quervernetzung zu kontrollieren.
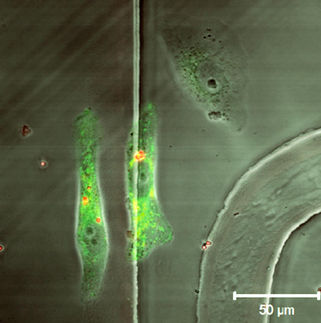
In weiteren Untersuchungen wurden die synthetischen Crosslinker bereits erfolgreich in lebende Zellen eingebracht. Diese wurden dadurch signifikant verlangsamt und deren Invasivität gesenkt. Diese initialen Untersuchungen geben Anlass zur Hoffnung, dass daraus einmal neue therapeutische Konzepte entspringen, beispielsweise zur Unterdrückung der Metastasierung von Tumoren oder zur Behandlung von Muskelerkrankungen, die durch fehlregulierte Quervernetzung von Stützproteinen hervorgerufen werden. Weitere Anwendungsmöglichkeiten eröffnen sich im Bereich programmierbarer Biomaterialien. Aktuell bilden diese Erkenntnisse die Basis für eine deutlich präzisere Erforschung mechanischer Zelleigenschaften und deren biologischer Regulation.