Über die Artengrenze hinweg: Mäusezucht in der Petrischale
Durchbruch in Stammzellentechnik ermöglicht genetische Untersuchung verschiedener Mäusearten ohne Kreuzung
Die Ursachen für Unterschiede zwischen den Arten ist ein großes Rätsel in der Biologie. Da Hybride aus Kreuzungen zweier Arten in der Regel steril sind, war eine genetische Kartierung in der Genetik sehr schwierig. Max Planck Forscher vom Friedrich Miescher Labor in Tübingen, haben jetzt die bahnbrechende Methode der „in vitro recombination“ zum Einsatz gebracht, bei der der Genaustausch direkt im Zellsystem erzielt wird. Dadurch konnten die Unterschiede zwischen Mausarten genetisch kartiert werden. Durch die Überwindung kreuzungsimmanenter Artgrenzen liefert diese Methode nun umfassende Einblicke in die Grundlagen genetischer Variation.
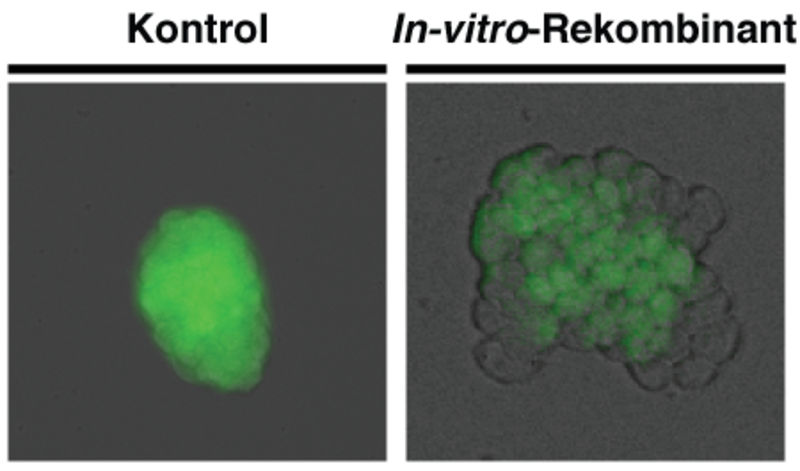
Fluoreszenzmarkierte Kolonien embryonaler Mausstammzellen, Kontrolle und nach der In-Vitro-Rekombinations-Methode kultivierte Zellen.
Stefano Lazzarano / MPI für Entwicklungsbiologie / FML
Schon seit dem Altertum fragt man sich, was am Ende die Unterschiede zwischen den vielen verschiedenen Arten bedingt. Heute können Biologen komplette Genome entschlüsseln, in Echtzeit Gene aufspüren, die sich selbst ein- und ausschalten, und sogar Gene von einer Art in eine andere Art einschleusen. Dennoch ist die Frage, welche Gen-Mutationen beispielsweise eine Hausmaus von ihren wilden Verwandten unterscheiden, immer noch schwer zu beantworten. Dies hängt auch damit zusammen, dass genetische Analysen, wie die von Mendel vor einem Jahrhundert durchgeführten Studien, umfassende Zuchtbemühungen zur Mischung der Genome erfordern. In der DNA-Sequenz des Genoms jeder Spezies sind jedoch viele genetische Barrieren kodiert, die eine Mischung über Artgrenzen hinweg durch Kreuzung verhindern und wie beispielsweise bei der Kreuzung von Eseln und Pferden zu sterilen Nachkommen führen.
Mithilfe von modernen Stammzelltechniken und raffinierten genetischen Manipulationen haben die Forscher des Tübinger Friedrich-Miescher-Labors einen Weg gefunden Genome zweier Mausarten in Hybridmäusen zu mischen. Diese Hybridmäuse, die wie ein Zell-Mosaik auf den Genomen der beiden gekreuzten Arten beruhen, enstanden nicht durch klassiche Zucht, sondern in einer einer Petrischale. Statt komplette Mäuse zu züchten, gewannen die Forscher die benötigten Stammzellen aus der frühen embryonalen Phase und kombinierten sie. Dem Tübinger Team gelang dieser Durchbruch durch die Manipulation der Zellteilung der embryonalen Stammzellen mit dem chemischen Inhibitor ML216. ML216 unterdrückt einen grundlegenden Mechanismus, der über ein Gen mit der Bezeichnung Bloom-Syndrom (Blm) gesteuert wird. Normalerweise verhindert Blm den Genaustausch während der Mitose. Die Unterdrückung von Blm ermöglichte einen Austausch von Chromosomen-Kopien zwischen den beiden unterschiedlichen Arten.
Um zu zeigen, dass diese Technik funktioniert, verglich das FML-Team die Labormaus Mus musculus musculus mit ihrer Schwesterart, der algerischen Maus Mus spretus. Ein bekannter Unterschied zwischen den beiden Arten ist, dass M. spretus dank eines Gens namens Hprt den zelltoxischen Wirkstoff Tioguanin nachweislich sehr viel schneller verstoffwechselt als Mus domesticus. Die Arbeitsgruppe von Frank Chan nutzte die neue In-vitro Rekombinationstechnik um das verantwortliche Gen Hprt für die Metabolisierung von Tioguanin in den Hybridstammzellen zu identifizieren. Behandelt man anschließend die Hybridstammzellen mit Tioguanin, überleben nur rekombinante Stammzellen eine hohe Tioguanin-Dosis. Nach dem Mischen der Hybrid-Genome, nutzten die Forscher die fluoreszenzaktivierte Zellsortierung, FACS, um die Hybridzellen in eine Tioguanin-resistente und eine –anfällige Gruppe auf zu trennen. Die nachfolgend eingesetztene neuesten DNA-Sequenzierungstechniken zeigten, dass in den Tioguanin-anfälligen Zellen sehr viel mehr M. spretus-Kopien des Hprt-Gens vorlagen als Kopien der Mus-domesticus-Variante, weil die M. spretus Hprt-Kopie wesentlich aktiver in der Umwandlung von Tioguanin ist, was zum Zelltod führt. Dies war die Bestätigung, dass die In-vitro-Rekombination verwendet werden kann, um die Grundlagen der genetischen Variation zwischen Mauslinien mit neuesten Stammzell- und Sequenzierungstechnologien zu kartieren - unter Umgehung der Artenbarriere.
Am beeindruckendsten war, dass dieses Experiment nur 3 Wochen dauerte, was der Zeit entspricht, in der eine einzelne Maus normalerweise ausgetragen wird. Mit Hilfe von Stammzellen, neuesten Sequenzierungstechniken und transgenen Verfahren haben Chan und Kollegen den Zukunftsweg für eine völlig neue Art von genetischen Untersuchungen aufgezeigt. Mit neuartigen „In-vitro-Rekombination“-Methoden lassen sich Genunterschiede in Säugetieren wie Mäusen sicher, schnell und zuverlässig direkt kartieren. Diese Vorgehensweise macht zudem umfassende Zuchtschritte überflüssig, was dazu beiträgt, die große Anzahl von Versuchstieren zu reduzieren. Begrüßenswert wäre, wenn diese Technik bei Anwendung auf menschliche Zellen über das Potenzial verfügt, zu Verbesserungen für Medizin und Therapien beizutragen.
Originalveröffentlichung
Lazzarano et al.; "Genetic mapping of species differences via in vitro crosses in mouse embryonic stem cells"; Proc Nat Acad Sci; 2018.

























































