Markierung von Proteinen mit Ubiquitin ermöglicht neue Forschung zur Zellregulation
Das Zünglein an der Waage
Menschliche Zelle verfügen über ein raffiniertes Regulierungssystem: die Markierung von Eiweißen mit dem kleinen Proteinmolekül Ubiquitin. Einem Team der Technischen Universität München (TUM) ist es jetzt erstmals gelungen, Proteine sowohl im Reagenzglas als auch in lebenden Zellen gezielt mit Ubiquitin zu versehen. Mit dem Verfahren lässt sich nun erforschen, wie dieses lebenswichtige Regulierungssystem funktioniert.
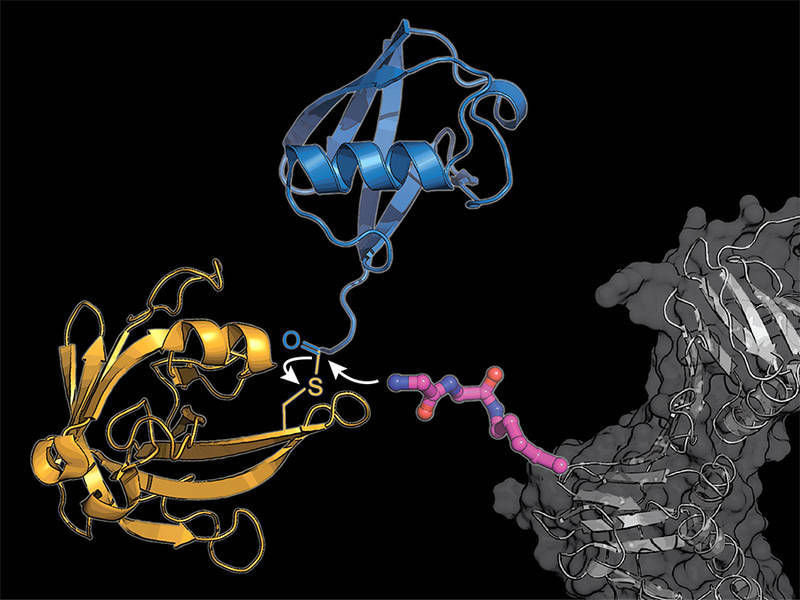
In ein zelluläres Protein (grau) bauten die Forschenden einen modifizierten Lysin-Aminosäurebaustein ein (pink), auf den das bakterielle Enzym Sortase (gelb) ein Ubiquitin-Molekül (blau) überträgt.
K. Lang / TUM
Pflanzen haben es, Pilze, Tiere und auch Menschen: das Protein Ubiquitin. Es besteht aus einer Abfolge von 76 Aminosäuren und ist damit ein eher kleines Biomolekül. Doch sein Einfluss ist weitreichend: Art, Position und Anzahl der an ein Protein gebundenen Ubiquitin-Moleküle bestimmen Stabilität, Funktion und Aufenthaltsort des Proteins innerhalb der Zelle.
„Praktisch jeder Prozess in der Zelle wird direkt oder indirekt durch Ubiquitin beeinflusst. Daher werden Fehlfunktionen dieses Markierungsmechanismus mit dem Entstehen und Fortschreiten von Krebs und vielen anderen schweren Krankheiten in Verbindung gebracht“, erklärt Kathrin Lang, Professorin für Synthetische Biochemie an der TU München.
Die Entdeckung der Rolle dieses zellulären Regulierungssystems beim kontrollierten Abbau von zu entsorgenden Proteinen wurde 2004 mit dem Chemie-Nobelpreis ausgezeichnet. Wie Ubiquitin-Modifikationen im Einzelnen die Funktion der Zelle beeinflussen, ist jedoch in vielen Fällen ungeklärt. Kathrin Langs Team hat nun ein Verfahren entwickelt, mit dem sich Ubiquitin-Markierungen gezielt an Zielproteinen anbringen lassen – ein Schlüssel zur Erforschung des Systems.
Ein bakterielles Enzym schafft neue Verbindungen
Die Strategie des Teams umgeht das komplizierte natürliche System mit zwei Tricks: In natürliche Proteine wird zunächst eine modifizierte Aminosäure eingebaut, an die dann das aus Bakterien stammende Enzym Sortase ein Ubiquitin oder ein Ubiquitin-ähnliches Molekül anhängen kann.
„Die größte Herausforderung lag darin, die verschiedenen Schritte – den Einbau der nicht natürlichen Aminosäure in ein Zielprotein und die Übertragung des Ubiquitins durch das Enzym Sortase – so aufeinander abzustimmen, dass sie nicht nur im Reagenzglas sondern auch in lebenden Zellen funktionieren“, erinnert sich Maximilian Fottner, der Erstautor der Studie.
Mittlerweile haben die Forscher an der TU München ihr neues Verfahren für viele verschiedene zelluläre Proteine optimiert und zum Patent angemeldet. „Wir haben bereits Kooperationen mit Medizinern und Zellbiologen gestartet, die nun gemeinsam mit uns die Auswirkungen von Ubiquitin-Markierungen auf das Entstehen von Krebs und neurodegenerativen Erkrankungen wie Parkinson auf molekularer Ebene studieren wollen“, freut sich Prof. Lang.
Originalveröffentlichung
"Site-specific ubiquitylation and SUMOylation using genetic-code expansion and sortase"; Maximilian Fottner, Andreas-David Brunner, Verena Bittl, Daniel Horn-Ghetko, Alexander Jussupow , Ville R. I. Kaila, Anja Bremm and Kathrin Lang; Nature Chemical Biology; 15, 276–284 (2019).
"Decoding without the cipher"; Amit Kumar Singh Gautam, Andreas Matouschek; Nature Chemical Biology; 15, 210–212 (2019).
Originalveröffentlichung
"Site-specific ubiquitylation and SUMOylation using genetic-code expansion and sortase"; Maximilian Fottner, Andreas-David Brunner, Verena Bittl, Daniel Horn-Ghetko, Alexander Jussupow , Ville R. I. Kaila, Anja Bremm and Kathrin Lang; Nature Chemical Biology; 15, 276–284 (2019).
"Decoding without the cipher"; Amit Kumar Singh Gautam, Andreas Matouschek; Nature Chemical Biology; 15, 210–212 (2019).
Organisationen
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Kjel- / Dist Line von Büchi
Kjel- und Dist Line - Wasserdampfdestillation und Kjeldahl-Anwendungen
Maximale Genauigkeit und Leistung für Wasserdampfdestillation und Kjeldahl-Anwendungen

AZURA Purifier + LH 2.1 von KNAUER
Präparative Flüssigkeitschromatografie - Neue Plattform für mehr Durchsatz
Damit sparen Sie Zeit und verbessern die Reproduzierbarkeit beim Aufreinigen

Holen Sie sich die Analytik- und Labortechnik-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.