Virulenzfaktor des Influenza-A-Virus in Echtzeit abgebildet
Die Influenza-A-Viren, die in der Vergangenheit tödliche Pandemien ausgelöst haben, sind bis heute ein großes globales Problem der öffentlichen Gesundheit. Moleküle, die als Virulenzfaktoren bekannt sind, werden von Bakterien, Viren und Pilzen produziert, um ihnen zu helfen, Wirtszellen zu infizieren. Einer der Virulenzfaktoren, die bei den Influenza-A-Viren vorkommen, ist Hämagglutinin (HA). Forscher der Kanazawa University haben kürzlich die Struktur von HA des Vogelgrippevirus, H5N1, mit Hilfe der Hochgeschwindigkeits-Atomkraftmikroskopie (HS-AFM) untersucht, und die Ergebnisse sind unerlässlich für die Entwicklung therapeutischer Ansätze gegen Influenza-A-Viren in Zukunft.
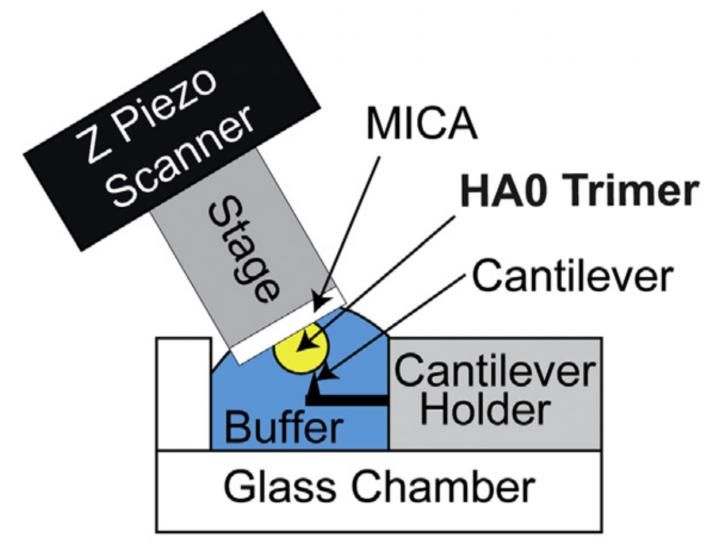
HS-AFM-Setup zur direkten Visualisierung des HA0-Trimers. Schematische Darstellung der HS-AFM-Einrichtung zum Scannen des HA0-Trimers.
Kanazawa University
HA wird zunächst von Wirtszellen in seiner Vorläuferform, dem so genannten HA0, synthetisiert. Die Umwandlung von HA0 in HA hängt von der Pathogenität der Influenza-A-Viren ab: extrazelluläre Umwandlung für niedrig pathogene Influenza-A-Viren und intrazelluläre Umwandlung für hoch pathogene Influenza-A-Viren. Daher ist das Verständnis der Struktur und der Eigenschaften von HA0 für die Entschlüsselung von HA von größter Bedeutung. Richard Wong und sein Forschungsteam versuchten daher, HA0 unter dem Mikroskop zu untersuchen. Das rekombinante HA0-Protein von H5N1 wurde visuell mit dem von der Kanazawa University entwickelten HS-AFM-System analysiert.
Sowohl HA0 als auch HA existieren in homotrimeren Formen und die Umwandlung von HA0 in HA verändert die homotrimere Struktur nicht wesentlich. Daher ist es sinnvoll, HA als Vorlage für die Erzeugung von HA0 HS-AFM-Simulationsbildern zu verwenden. Die saure endosomale Umgebung ist der entscheidende Faktor für HA, um die Fusion zwischen Virusmembran und endosomaler Membran zu induzieren, um virale Materialien in die Wirtszellen freizusetzen. Um die saure Wirkung auf HA0 zu verdeutlichen, wurde es zunächst einer sauren Umgebung ausgesetzt. Der Trimer von HA0 erwies sich als sehr empfindlich gegenüber der sauren Lösung und expandierte stark. Als Konformationsänderungen von Hämagglutinin in Echtzeit mit HS-AFM gemessen wurden, stellte das Team fest, dass seine Fläche größer und seine Höhe kürzer war. Die saure Umgebung machte das Molekül im Vergleich zu seinem ursprünglichen Gegenstück im Wesentlichen flacher und kreisförmiger. Diese Konformationsänderung war jedoch reversibel, da die Struktur nach der Neutralisation wieder in ihre ursprüngliche Form zurückkehrte.
"Unsere Pilotarbeit etabliert HS-AFM als unnachahmliches Werkzeug zur direkten Untersuchung der viralen Proteindynamik, die mit rauscharmen Techniken, die auf der Mittelung des Ensembles beruhen, wie Cyro-EM und Röntgenkristallographie, schwer zu erfassen ist", sagt Hauptautor der Studie Dr. Kee Siang Lim. "Mit hoher Scangeschwindigkeit und einem minimal-invasiven Cantilever sagen wir voraus, dass HS-AFM in der zukünftigen Studie den Fluss irreversibler Konformationsänderungen von HA2 durch den niedrigen pH-Wert aufdecken kann, der die wahren biologischen Ereignisse nachahmt, die auftreten, wenn HA in ein Wirtsendosom gelangt."
Diese Studie ebnete den Weg für die Untersuchung biologischer Ereignisse in Viren in Echtzeit. Die Autoren betonen die Bedeutung von HS-AFM für diese Forschung: "Unsere Arbeit etabliert HS-AFM als unnachahmliches Werkzeug zur direkten Untersuchung der viralen Proteindynamik, die mit rauscharmen Techniken, die auf Ensemble-Mittelwertbildung beruhen, wie Cyro-EM und Röntgenkristallographie, schwer zu erfassen ist", erklärt Dr. Richard Wong, Senior-Autor der Studie.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.
Originalveröffentlichung
Meistgelesene News
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Analytik- und Labortechnik-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte
Biomimetische Moleküle zur Programmierung der Zellmechanik
SureSTART Vials and Well Plates | Verbrauchsmaterialien | Thermo Fisher Scientific