Auf dem Weg zur Nanotheranostik
Die Theranostik ist ein aufstrebender Bereich der Medizin, dessen Name eine Kombination aus "Therapie" und "Diagnose" ist. Die Idee der Theranostik besteht darin, Medikamente und/oder Techniken zur gleichzeitigen - oder sequentiellen - Diagnose und Behandlung von Krankheiten zu kombinieren und auch die Reaktion des Patienten zu überwachen. Dies spart Zeit und Geld, kann aber auch einige der unerwünschten biologischen Effekte umgehen, die auftreten können, wenn diese Strategien separat eingesetzt werden.
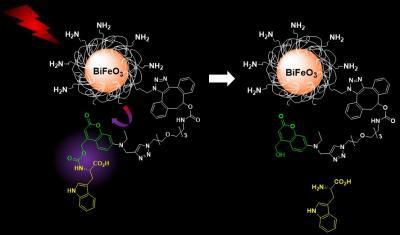
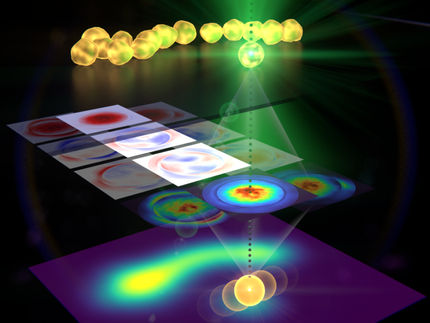
Die Anregung von funktionalisierten Wismutferrit-Nanopartikeln im Nahinfrarotbereich führt zu einer harmonischen Emission, die die Photorelease von in Käfigen eingeschlossenen molekularen Ladungen auslöst, was eine entkoppelte Bildgebung und kontrollierte Abgabeanwendungen ermöglicht.
S. Gerber (EPFL)
Heutzutage verwenden Theranostik-Anwendungen zunehmend Nanopartikel, die Diagnosemoleküle und Medikamente zu einem einzigen Wirkstoff vereinen. Die Nanopartikel fungieren als Träger für molekulare "Ladung", z.B. ein Medikament oder ein Radioisotop für Krebspatienten in der Strahlentherapie, die auf bestimmte biologische Wege im Körper des Patienten abzielen und gleichzeitig Schäden an gesundem Gewebe vermeiden.
Am Zielgewebe angekommen, erzeugen die Nanopartikel diagnostische Bilder und/oder liefern ihre Ladung. Dies ist die Spitzentechnologie der "Nanotheranostik", die zu einem Schwerpunkt der Forschung geworden ist - wenn auch mit vielen Einschränkungen.
Nun hat das Labor von Sandrine Gerber an der EPFL in Zusammenarbeit mit Physikern der Universität Genf ein neues nanotherapeutisches System entwickelt, das mehrere Probleme mit früheren Ansätzen überwindet. Das System verwendet "Harmonic Nanoparticles" (HNPs), eine Familie von Metalloxid-Nanokristallen mit außergewöhnlichen optischen Eigenschaften, insbesondere ihrer Emission als Reaktion auf die Anregung von ultraviolettem bis infrarotem Licht und ihrer hohen Photostabilität. Es war diese Eigenschaft, die HNPs in die Nanotheranostik brachte, als Wissenschaftler versuchten, einige Probleme mit fluoreszierenden Sonden zu lösen.
"Die meisten lichtaktivierten nanotherapeutischen Systeme benötigen hochenergetisches UV-Licht, um ihre photoreaktiven Gerüste anzuregen", sagt Gerber. "Das Problem ist, dass dies zu einer geringen Eindringtiefe führt und lebende Zellen und Gewebe schädigen kann, was die biomedizinische Anwendung einschränkt."
Das neue System, das Gerber's Gruppe entwickelt hat, vermeidet diese Probleme, indem es silica-beschichtete HNPs mit Wismut-Ferrit verwendet, die mit lichtreaktiven Molekulargütern mit Käfigstruktur funktionalisiert sind. Diese Systeme können einfach mit Nahinfrarotlicht (Wellenlänge 790 Nanometer) aktiviert und mit längerer Wellenlänge für Detektions- und Freisetzungsprozesse abgebildet werden. Beide Eigenschaften machen das System medizinisch sicher für den Patienten.
Einmal lichtausgelöscht, geben die HNPs ihre Ladung frei - in diesem Fall L-Tryptophan, das als Modell dient. Die Wissenschaftler überwachten und quantifizierten die Freisetzung mit einer Technik, die Flüssigkeitschromatographie und Massenspektrometrie kombiniert und den bilddiagnostischen Teil des nanotherapeutischen Systems abdeckt.
Die Autoren stellen fest, dass "diese Arbeit ein wichtiger Schritt in der Entwicklung von Nanocarrier-Plattformen ist, die eine entkoppelte Bildgebung in Gewebetiefe und die bedarfsgerechte Freisetzung von Therapeutika ermöglichen".
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.
Originalveröffentlichung
Jérémy Vuilleumier, Geoffrey Gaulier, Raphaël De Matos, Daniel Ortiz, Laure Menin, Gabriel Campargue, Christophe Mas, Samuel Constant, Ronan Le Dantec, Yannick Mugnier, Luigi Bonacina, Sandrine Gerber-Lemaire; "Two-photon triggered photorelease of caged compounds from multifunctional harmonic nanoparticles"; ACS Applied Materials and Interfaces; 05 July 2019