Happy hour für die zeitaufgelöste Kristallographie
Forschungsteam vereinfacht die zeitaufgelöste Röntgenkristallografie
Ein Forschungsteam vom Max-Planck-Institut für Struktur und Dynamik der Materie (MPSD), der Universität Hamburg und dem European Molecular Biology Laboratory (EMBL) hat eine neue Methode entwickelt, um Biomoleküle bei der Arbeit zu beobachten. Sie macht es bedeutend einfacher, enzymatische Reaktionen auszulösen, da hierzu ein Cocktail aus kleinen Flüssigkeitsmengen und Proteinkristallen angewandt wird. Ab dem Zeitpunkt des Mischens werden die Proteinstrukturen in definierten Abständen bestimmt. Mit der dadurch entstehenden Zeitraffersequenz können nun die Bewegungen der biologischen Moleküle abgebildet werden.

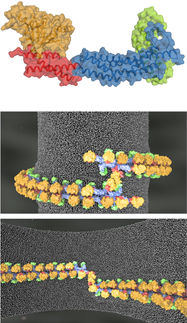
Die 'Liquid Application Method for time-resolved Analyses' (LAMA) lässt sich auf alle diffusionsgeeignenten Proteinkristallsysteme anwenden
© Jörg Harms / MPSD
Die Funktionen von Biomolekülen werden nicht nur durch ihre molekularen Strukturen, sondern auch durch deren Veränderungen bestimmt. Mittels der zeitaufgelösten Röntgenkristallographie lassen sich Schnappschüsse eines reagierenden Biomoleküls aufnehmen, die wiederum unser Verständnis dieser dynamischen Bewegungen vertiefen. Allerdings stellt das Auslösen dieser Reaktionen selbst eine große Herausforderung dar, denn typischerweise müssen die Forscher auf optisch ausgelösten Reaktionen mit speziellen Lasern zurückgreifen.
Die neue ‚Liquid Application Method for time-resolved Analyses’ (LAMA) umgeht diese optischen Auslöser. Sie ist maßgeschneidert für die Untersuchung biologisch relevanter Reaktionszeitskalen, die von wenigen Millisekunden (10-3) bis hin zu Sekunden oder sogar Minuten andauern. Für Biologen und pharmazeutische Wissenschaftler sind diese Zeitskalen besonders relevant, denn dort geschehen die strukturellen Änderungen, die eine spezifische biologische Funktion oder die Katalyse eines Medikaments bestimmen.
Mit den hochintensiven, mikrofokussierten Röntgenstrahlen der EMBL-Beamline P14-2 am Deutschen Elektronen Synchrotron (DESY) konnte so ein Enzym das Zucker umwandelt auf der Millisekundenskala untersucht werden. Durch die neue ‚LAMA‘-Methode ließ sich das gesamte Experiment bedeutend einfacher gestalten als mit herkömmlichen Methoden.
Einige Pikoliter (10-12) Zuckerlösung wurden mit Mikrokristallen des Enzyms gemischt. Daraufhin wurden Schnappschüsse der Reaktion aufgenommen, während das Enzym die ringförmige Zuckerstruktur in eine offene Kette umwandelte.
Diese neue Methode birgt besonderes Potential für hochbrilliante Synchrotron-Strahlungsquellen, da sie Wissenschaftlern nun eine viel größere Anzahl an zeitaufgelösten kristallographischen Untersuchungen ermöglicht.
Am PETRA III-Synchrotron des DESY wird die LAMA-Methode schon jetzt als die Standardoption für die neue zeitaufgelöste, makromolekulare Kristallographie-Messstation der EMBL-Beamline P14-2 eingesetzt.
Die Nutzung solcher bahnbrechenden Technologien gewährt Forschern bessere Einblicke in biochemische Prozesse und mögliche Antworten auf drängende Umwelt- und Gesundheitsfragen.
Originalveröffentlichung
Meistgelesene News
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Analytik- und Labortechnik-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.