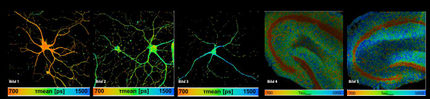
Superresolution-Live-Cell-Imaging gewährt unerwartete Einblicke in den dynamischen Aufbau von Mitochondrien
Mitochondrien sind als Kraftwerke und Energiespeicher essentielle Bestandteile von nahezu allen Zellen in Pflanzen, Pilzen und Tieren. Bisher nahm man an, dass diese Funktionen einem statischen Aufbau der mitochondrialen Membranen zu Grunde liegen. Forscher der Heinrich-Heine-Universität Düsseldorf (HHU) und der University of California Los Angeles (UCLA) und haben nun herausgefunden, dass die Innenmembranen der Mitochondrien keineswegs statisch sind, sondern ihre Struktur ständig, und zwar alle paar Sekunden, in lebenden Zellen ändern. Dieser dynamische Anpassungsprozess erhöht noch einmal die Leistungsfähigkeit unserer zellulären Kraftwerke.
„Diese Erkenntnis ändert nach unserer Einschätzung grundsätzlich die Sichtweise, wie unsere zellulären Kraftwerke funktionieren und wird vermutlich die Lehrbücher verändern“, sagt Prof. Dr. Andreas Reichert, Institut für Biochemie und Molekularbiologie I der HHU.
Mitochondrien sind extrem wichtige Bestandteile von Zellen, da sie unter anderem für die geregelte Umwandlung von Energie aus der Nahrung in chemische Energie in Form von Adenosintriphosphat (ATP) notwendig sind. ATP ist die Energiewährung der Zellen und pro Tag produziert und verbraucht ein erwachsener Mensch circa 75 Kilogramm ATP. Dabei wird ein Molekül ATP pro Tag circa 20.000-mal produziert und anschließend wieder zur Energieverwertung verbraucht. Diese immense Syntheseleistung erfolgt in der Innenmembran der Mitochondrien, die zahlreiche Einfaltungen aufweist. Diese nennen sich Cristae und man ging bisher davon aus, dass je nach Zelltyp ein bestimmter statischer Aufbau der Cristae die Synthese von ATP gewährleistet. Ob und inwieweit Cristae-Membranen ihre Struktur dynamisch in lebenden Zellen anpassen oder ändern können und welche Proteine dafür notwendig sind, war bisher unbekannt.
Dem Forscherteam von Prof. Dr. Andreas Reichert mit Dr. Arun Kondadi und Dr. Ruchika Anand vom Institut für Biochemie und Molekularbiologie I der HHU in Kooperation mit dem Forschungsteam um Prof. Dr. Orian Shirihai und Prof. Dr. Marc Liesa von der UCLA (USA) gelang es erstmals zu zeigen, dass Cristae-Membranen in lebenden Zellen kontinuierlich, im Rahmen von Sekunden, ihre Struktur dynamisch innerhalb der Mitochondrien ändern. Sie konnten zudem nachweisen, dass dafür ein erst kürzlich identifizierter Proteinkomplex, der MICOS-Komplex, notwendig ist. Fehlfunktionen des MICOS-Komplexes können zu diversen schweren Erkrankungen führen, wie Morbus Parkinson und einer Form der mitochondrialen Enzephalopathie mit Leberschädigung. Nach der Identifikation der ersten Proteinkomponente dieses Komplexes (Fcj1/Mic60) vor circa zehn Jahren durch Prof. Andreas Reichert und seine Arbeitsgruppe, ist dies ein weiterer wichtiger Baustein die Funktion des MICOS-Komplexes besser zu verstehen.
„Unsere nun publizierten Beobachtungen führen zu dem Modell, dass Cristae nach Membranabschnürungen auch kurzzeitig als isolierte Vesikel innerhalb von Mitochondrien existieren und dann wieder mit der Innenmembran refusionieren können. Dies erlaubt eine optimale und extrem schnelle Anpassung an energetische Anforderungen in einer Zelle“, sagt Prof. Andreas Reichert.
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Zellanalyse
Die Zellanalyse ermöglicht es uns, Zellen in ihren vielfältigen Facetten zu erforschen und zu verstehen. Von der Einzelzellanalyse über die Durchflusszytometrie bis hin zur Bildgebungstechnologie – die Zellanalyse bietet uns wertvolle Einblicke in die Struktur, Funktion und Interaktion von Zellen. Ob in der Medizin, der biologischen Forschung oder der Pharmakologie – die Zellanalyse revolutioniert unser Verständnis von Krankheiten, Entwicklung und Behandlungsmöglichkeiten.
Themenwelt Zellanalyse
Die Zellanalyse ermöglicht es uns, Zellen in ihren vielfältigen Facetten zu erforschen und zu verstehen. Von der Einzelzellanalyse über die Durchflusszytometrie bis hin zur Bildgebungstechnologie – die Zellanalyse bietet uns wertvolle Einblicke in die Struktur, Funktion und Interaktion von Zellen. Ob in der Medizin, der biologischen Forschung oder der Pharmakologie – die Zellanalyse revolutioniert unser Verständnis von Krankheiten, Entwicklung und Behandlungsmöglichkeiten.