Eine Art Fischer-Dübel der Biophysik
Verhalten von Biomolekülen unter mechanischem Stress analysiert
Die Interaktion zwischen den Molekülen Biotin und Streptavidin ist ein wichtiges Werkzeug in der Forschung. LMU-Physiker haben die mechanische Stabilität dieser Verbindung nun detailliert untersucht und zeigen: Es kommt auf die Geometrie an.
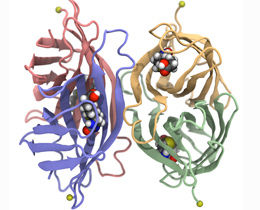
Streptavidin besteht aus vier identischen Untereinheiten (hier in grün, blau, gelb und rot), in die jeweils ein Biotin Molekül (bunte Kugeln) binden kann. Im Experiment wird Streptavidin an einem der Ankerpunkte (einzelne gelbe Kugel) festgehalten, während ein Biotin-Molekül aus einer der Bindungstaschen gezogen wird.
Rafael C. Bernardi
Mechanische Kräfte beeinflussen viele biologische Systeme, etwa wenn Muskelzellen kontrahieren und sich wieder ausdehnen. Auch bestimmte zelluläre Signalkaskaden – beispielsweise bei der Autoregulation von Gefäßen – werden durch mechanische Kräfte in Gang gesetzt. Um die molekularen Mechanismen solcher Prozesse zu untersuchen, analysieren Wissenschaftler das Verhalten von Biomolekülen unter mechanischem Stress. LMU-Biophysiker um Professor Hermann Gaub haben in Kooperation mit Rafael Bernardi vom Beckman Institute in Illinois (USA) ein wichtiges Werkzeug für solche Analysen detailliert untersucht und zeigen: Die Geometrie des Werkzeugs wirkt sich auf dessen Stabilität aus und sollte für einen optimalen Einsatz berücksichtigt werden.
Molekulare Dübel
Wie Biomoleküle auf mechanische Kräfte reagieren, untersuchen Biophysiker mit der sogenannten Einzelmolekül-Kraftspektroskopie. Dabei wird das zu untersuchende Biomolekül zwischen zwei anderen Molekülen befestigt und dann der Abstand zwischen diesen langsam vergrößert. Ein beliebtes Werkzeug für die Befestigung von Biomolekülen ist die Interaktion des Vitamins Biotin mit dem Protein Streptavidin. „Dieses Rezeptor-Liganden-System ist quasi der Fischer-Dübel der Biophysik“, sagt Steffen Sedlak, Mitarbeiter in Gaubs Team und Erstautor des Papers.
Das zu untersuchende Biomolekül bindet dabei an Biotin, das wiederum mit hoher Affinität an Streptavidin bindet. Die mechanische Stabilität der Interaktion von Biotin und Streptavidin spielt für die Experimente eine wichtige Rolle. Nachdem Gaub das System vor 25 Jahren erstmals kraftspektroskopisch untersucht hatte, wurde sie in zahlreichen Labors auf der ganzen Welt gemessen. Dabei waren die Ergebnisse uneinheitlich und erstreckten sich über einen recht großen Bereich. Die Gründe dafür haben die Wissenschaftler nun untersucht.
Streptavidin besteht aus vier gleichen Untereinheiten, sogenannten β-Fässern, die man sich als zylinderförmige Hohlräume vorstellen kann. In jedes dieser Fässer kann ein Biotin-Molekül binden. Wie bei echten Fässern gibt es auch für die Streptavidin-Untereinheiten einen Deckel. Dieser schließt sich, sobald Biotin gebunden hat. Dann ragt nur noch ein Ende von Biotin durch eine kleine Öffnung aus dem Fass, an diesem Ende ist das zu untersuchende Biomolekül befestigt.
Aus dem Fass gezogen
Für ihre Untersuchungen entwarfen die Wissenschaftler spezielle Streptavidin-Varianten, die jeweils nur mit einer bestimmten Untereinheit Biotin binden konnten – die restlichen drei Fässer blieben dabei leer. Um die Stabilität der Bindung zu untersuchen, zogen die Wissenschaftler dann einzelne Biotine aus dieser Tasche „Dabei haben wir entdeckt, dass unterschiedlich viel Kraft benötigt wird, je nachdem, aus welchem der vier Fässer Biotin herausgezogen wird – und das obwohl die vier Bindungstaschen exakt gleich sind“, sagt Gaub.
Die Position der Bindung entscheidet
Mithilfe aufwendiger Computersimulationen gelang es den Wissenschaftlern, die Ursache dieser Unterschiede aufzuklären: Die Bindungstaschen nehmen relativ zu dem Punkt, an dem die Zugbelastung ansetzt, unterschiedliche Positionen ein. Daraus ergeben sich verschiedene Zuggeometrien: Besonders leicht gibt die Bindung nach, wenn Biotin bei Belastung gegen den flexiblen Deckel des β-Fasses drückt. Wird die Bindung jedoch an anderen Stellen belastet, kann das System sehr hohe Kräfte aushalten. „Wie auch Diogenes gewiss schon festgestellt hat, ist es eben wesentlich leichter, ein Fass durch den Deckel zu verlassen als durch die Wand“, sagt Sedlak. „Dass dies auch bei mechanischen Kräften zwischen einzelnen Biomolekülen gilt, ist allerdings alles andere als trivial.“
Die Wissenschaftler sind überzeugt, dass ihre Erkenntnisse dazu beitragen werden, Streptavidin zukünftig optimal einzusetzen – nun kann der molekulare Dübel so befestigt werden, dass er mechanisch besonders stabil ist.
Originalveröffentlichung
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!

Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!