Neue Einzelzell-RNA-Seq zur präzisen Charakterisierung von zellspezifischer Arzneimittelwirkungen in Pankreas-Zellen
Erkenntnisse könnten neue therapeutische Wege zur Behandlung von Typ-1-Diabetes eröffnen
Forscher der Gruppen um Stefan Kubicek und Christoph Bock am CeMM in Wien haben eine Methode entwickelt, mit der sich die Wirkung von chemischen Substanzen in isoliertem Pankreasgewebe durch den Einsatz einer verfeinerten Einzelzell-RNA-Sequenzierungsmethode präzise beurteilen lässt. Ihre in der Fachzeitschrift Genome Biology veröffentlichte Studie beschreibt das neue Verfahren, welches RNA-Kontamination eliminiert und für die dynamische Arzneimittelantwort in Bauchspeicheldrüsenzellen genaue Ergebnisse ermöglichte. Diese Erkenntnisse werden die Entwicklung zielgerichteter Arzneimitteltherapien zur Behandlung von Typ-1-Diabetes in der Zukunft unterstützen.
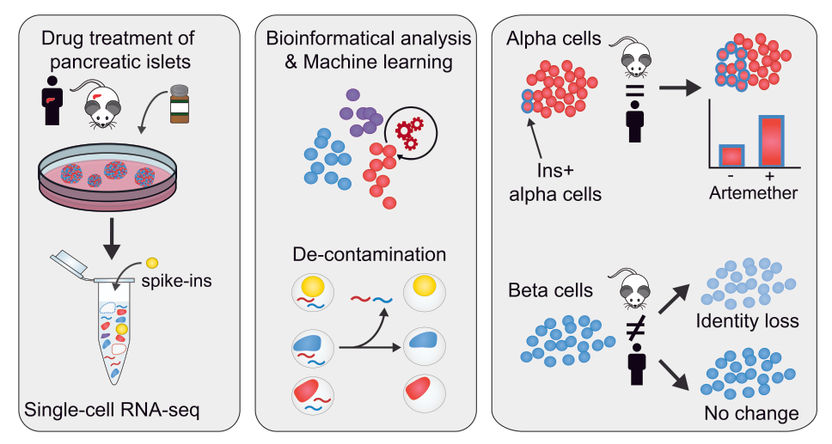
Graphical abstract
B. Marquina-Sánchez N. Fortelny
Die Bauchspeicheldrüse ist ein Organ, das sowohl Verdauungsenzyme als auch Hormone, welche den Blutzuckerspiegel regeln, bildet. Die hormonbildende Funktion ist in den Langerhans'schen Inseln angesiedelt, welche aus Gruppen verschiedener endokriner Zelltypen bestehen. Dazu gehören Betazellen, welche das Hormon Insulin produzieren, das zur Senkung des Blutzuckerspiegels benötigt wird. Ein weiterer Zelltyp sind Alphazellen, welche das für die Erhöhung des Glukosespiegels verantwortliche Hormon Glukagon produzieren.
Beim Typ-1-Diabetes handelt es sich um eine chronische Erkrankung, bei der das körpereigene Immunsystem die insulinproduzierenden Betazellen der Bauchspeicheldrüse fälschlicherweise angreift und zerstört. Ansätze der regenerativen Medizin zielen darauf ab, die Betazellmasse wiederherzustellen und die aktuellen Insulinersatztherapien damit letztendlich zu ersetzen. Veränderungen der Inselzellen, wie eine unzureichende Funktion und Dedifferenzierung der Betazellen, tragen auch zur Entstehung von Typ-2-Diabetes bei. Daher führt ein tieferes Verständnis der Identität und des Zusammenspiels zwischen den verschiedenen Inselzelltypen zu einer besseren Charakterisierung beider Diabetesformen und kann zur Entwicklung neuer therapeutischer Konzepte beitragen.
Die Einzelzell-RNA-Sequenzierung ist eine leistungsfähige Technik zur Charakterisierung der zellulären Identität. CeMM-Forscher aus den Gruppen um Christoph Bock und Stefan Kubicek am CeMM hatten schon 2016 die ersten Einzelzell-RNA-Profile von primären menschlichen Pankreasinselzellen veröffentlicht (EMBO Rep. 2016 Feb 17;(2):178-87). Fortschritte in dieser Technologie haben seither ihre Anwendung bei der Erstellung globaler Einzelzell-RNA-Karten von Mensch und Maus ermöglicht. Trotz dieser Fortschritte sind Einzelzellansätze nach wie vor technologisch anspruchsvoll, da in jeder Zelle nur minimale RNA-Mengen vorhanden sind, die im Rahmen des Experiments vollständig aufgebraucht werden. Daher ist es unerlässlich, die Qualität und Reinheit der resultierenden Einzelzell-RNA-Profile sicherzustellen.
CeMM Forscher aus den beiden beitragenden Laboren haben sowohl in ihrem eigenen Datensatz als auch in anderen veröffentlichten Einzelzellstudien eine unerwartet erhöhte Hormonexpression in nicht endokrinen Zelltypen festgestellt. Sie machten sich daran, abzuklären, ob diese auf die Kontamination durch RNA-Moleküle, beispielsweise aus sterbenden Zellen, zurückzuführen war und wie sie beseitigt werden könnte, um einen verlässlicheren Datensatz zu erhalten. Eine solche Kontamination scheint in den Einzelzell-RNA-Seqenzierungs-Daten aus den meisten Geweben präsent zu sein, war jedoch in den Pankreasinselzellen besonders einfach zu erkennen. Endokrine Inselzellen widmen sich nämlich ausschließlich der Produktion einzelner Hormone, und Insulin in den Betazellen sowie Glukagon in den Alphazellen werden in höheren Mengen exprimiert als klassische "Housekeeping"-Gene. Daher war die Umverteilung dieser Transkripte auf andere Zelltypen besonders stark ausgeprägt. Auf Grundlage dieser Beobachtung war es das Ziel der ForscherInnen, eine Methode zur experimentellen Bestimmung und rechnerischen Beseitigung einer solchen Kontamination zu entwickeln, zu validieren und anzuwenden.
Im Zuge ihrer Forschungsarbeit fügten die CeMM-Forscher ihren Pankreasinselzellproben vollständig charakterisierte andere humane und Maus-Zellen hinzu, sogenannte „Spike-in“ Zellen. Damit war es möglich, den Grad der RNA-Kontamination im Einzelzell-RNA-Seq intern und genau zu kontrollieren, da die in den Maus-“Spike-in“-Zellen nachgewiesenen menschlichen Transkripte kontaminierende RNA darstellen müssen. Auf diese Weise stellten sie fest, dass die Proben einen Kontaminationsgrad von bis zu 20% aufwiesen und sie die Kontamination der einzelnen Proben bestimmen konnten. Dann entwickelten sie einen neuartigen Bioinformatik-Ansatz zur Beseitigung kontaminierender Messwerte aus Einzelzell-RNA-Profilen.
Nachdem sie nun gereinigte Einzelzell-RNA-Profile erstellt hatten, bestimmten sie die Reaktion der zellulären Identität in den verschiedenen Zelltypen auf die Behandlung mit drei verschiedenen Arzneimitteln. Sie stellten fest, dass ein molekularer Inhibitor des Transkriptionsfaktors FOXO1 in sowohl Alpha- als auch Betazellen eine Dedifferenzierung hervorruft. Außerdem untersuchten sie Artemether, für das eine die Identität von Alphazellen beeinträchtigt und das die Insulinproduktion sowohl in in-vivo- als in in-vitro-Studien in Gang setzen konnte (Cell. 2017 Jan 12;168(1-2):86-100.e15). Die Wirkung des Arzneistoffes Artemether war artspezifisch und zelltypspezifisch. Sowohl in Maus- also auch Humanproben erhöht Artemether in einem Teil der Alphazellen die Expression von Insulin und weiteren Betazellgenen. In Betazellen hingegen zeigte sich in menschlichen Proben keine signifikante Veränderung der Insulinexpression, während es in Mausinseln zu einer Verminderung ihrer Betazellenidentität insgesamt kommt.
Diese Studie ist das Ergebnis einer interdisziplinären Zusammenarbeit der Labore von Stefan Kubicek und Christoph Bock am CeMM mit Patrick Collombat am Institut de Biologie Valrose (Frankreich). Diese Studie ist die erste, in der die Einzelzell-Sequenzierung zur Analyse der dynamischen Arzneimittelantwort in intaktem, isoliertem Gewebe zum Einsatz kommt, dass von der hohen quantitativen Genauigkeit der Dekontaminierungsmethode profitiert hat. Sie liefert daher nicht nur eine neue Methode der Einzelzell-Dekontamination und der hoch quantitativen Einzelzellanalyse der Arzneimittelantworten in intakten Geweben, sondern behandelt auch eine wichtige aktuelle Frage der Inselzellbiologie und der Diabetesforschung. Diese Erkenntnisse könnten für die Behandlung von Typ-1-Diabetes in der Zukunft neue therapeutische Wege eröffnen.