Mechanismus entdeckt, wie das Coronavirus die Zelle kapert
Ansatzpunkt für die Impfstoff- und Medikamentenentwicklung
Forscher der ETH Zürich und der Universität Bern haben einen Mechanismus entdeckt, wie das Coronavirus menschliche Zellen manipuliert, um seine eigene Vermehrung sicherzustellen. Dieses Wissen wird helfen, Medikamente und Impfstoffe gegen das Coronavirus zu entwickeln.
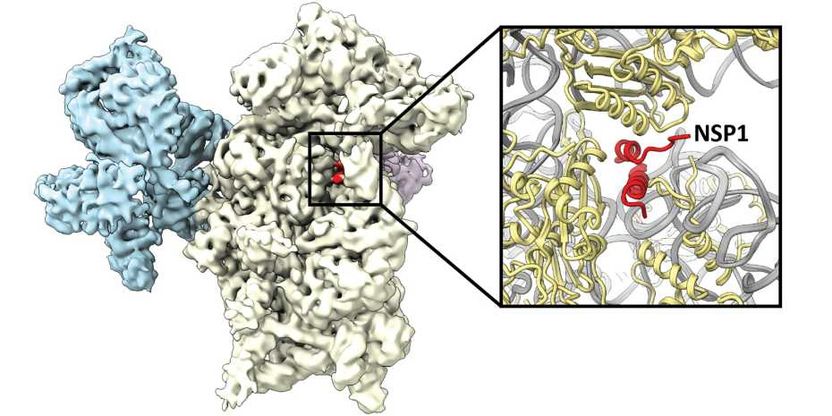
Das Virusprotein NSP1 (rot) lagert sich an das Ribosom (weiss und blau) an und hemmt dadurch die Produktion von Proteinen der menschlichen Zelle.
ETH Zürich / Nenad Ban
Wie ein Pirat, der ein Schiff kapert, übernimmt ein Virus die Kontrolle über eine infizierte Zelle, denn jedes Virus ist für seine Vermehrung auf die Ressourcen und molekularen Maschinen der Zelle angewiesen. Das gilt auch für Sars-CoV-2, den Auslöser der Covid-19-Pandemie. Forscher der ETH Zürich und der Universität Bern haben nun einen Mechanismus entdeckt, den das Coronavirus benutzt, um die Herstellung seiner Proteine gegenüber den zelleigenen zu bevorzugen. Dieser Mechanismus führt dazu, dass die Zellen die Produktion der eigenen Proteine stark reduzieren und stattdessen fast nur noch Virusproteine produzieren. So wird nicht nur die Produktion neuer Viren angeregt, sondern auch die Immunantwort gegen die Coronainfektion gehemmt.
Nachdem bei einer Sars-CoV-2 Infektion das Virus in eine menschliche Zelle eingeschleust wurde, wird das Protein NSP1 als eines der ersten Virusproteine hergestellt. Von anderen Coronaviren wusste man bereits, dass NSP1 die Produktion von zelleigenen Proteinen hemmt, jedoch war bisher nicht bekannt, wie dies geschieht. Nun haben die Wissenschaftler der ETH Zürich und Universität Bern herausgefunden, wie NSP1 die zelluläre Proteinproduktion hemmt. Diese Arbeit wurde nun veröffentlicht. Sie ergänzt die Erkenntnisse, welche ein anderes Forscherteam aus Deutschland jüngst publizierte.
Ansatzpunkt für die Impfstoff- und Medikamentenentwicklung
Ribosomen sind die zellulären Maschinen, welche Proteine herstellen. Dazu lesen sie den Bauplan, die sogenannte Boten-RNA, für ein gegebenes Protein ab und fügen die Aminosäuren in der entsprechenden Reihenfolge zusammen. Beim Ablesen passiert die Boten-RNA einen Kanal im Ribosom. Die Forscher konnten zeigen, dass NSP1 innerhalb des Kanals bindet und so das Ribosom blockiert. Mittels der Kryo-Elektronenmikroskopie konnte die Bindungsstelle von NSP1 mit atomarer Auflösung dargestellt werden. «Dieses detaillierte Abbild liefert wichtige Informationen zum Design eines möglichen künftigen Medikamentes, welches die Bindung von NSP1 verhindert, die ribosomale Funktion aber nicht beeinträchtigt. Wenn NSP1 nicht mehr mit dem Ribosom interagieren kann, wird die zelluläre Immunantwort angeregt und die Virusvermehrung gestoppt», erläutert Nenad Ban, Professor für Molekularbiologie an der ETH Zürich und Mitautor der Studie.
Mittels biochemischer und zellulärer Experimente konnten die Forschenden zeigen, dass NSP1 allein genügt, um die Proteinproduktion zu hemmen. Basierend auf dem detaillierten Abbild der Bindungsweise von NSP1 konnten sie abgeänderte NSP1 Varianten herstellen, die ihre hemmende Wirkung verloren haben. Sars-CoV-2 Viren mit solchen inaktiven Varianten des NSP1 Proteins würden so abgeschwächt sein, dass sie sich nicht mehr vermehren und somit auch keine starke Krankheit mehr auslösen können. Solche abgeschwächten, inaktiven Viren können als Impfstoff verwendet werden; ein Prinzip, auf dem bereits viele andere Impfungen gegen Viruskrankheiten basieren.
Weiterhin interessierte die Wissenschaftler die Frage, warum die Virenproteine in grossen Mengen hergestellt werden trotz der Hemmung der Ribosomenfunktion durch NSP1. Sie fanden heraus, dass die virale RNA die Eigenschaft hat, verglichen zu den zellulären Boten-RNAs, sehr effizient von den Ribosomen abgelesen zu werden. «Durch die Blockierung von Ribosomen durch NSP1 werden funktionsfähige Ribosomen knapp, und gleichzeitig kann die virale RNA fast die Hälfte der gesamten RNA in der Zelle ausmachen. Unter diesen Bedingungen wird die virale RNA von den noch funktionsfähigen Ribosomen gegenüber den zelleigenen Boten-RNAs bevorzugt abgelesen.» erklärt Oliver Mühlemann, Professor für Biochemie an der Universität Bern und ebenfalls Mitautor der Studie.
Forschungsprojekt in Rekordzeit
Von Beginn des Forschungsprojektes bis zur Publikation sind nur wenige Monate vergangen. «Die komplementäre Expertise der beteiligten Forschenden erlaubte ein sehr schnelles und effizientes Vorankommen in diesem Projekt», sagt Oliver Mühlemann. Alle drei beteiligten Forschungsgruppen sind Teil des Nationalen Forschungsschwerpunktes (NFS) RNA & Krankheit, welcher vom Schweizer Nationalfonds sowie der Universität Bern und der ETH Zürich finanziert wird. Die drei Forschungsgruppen werden weiterhin eng zusammenarbeiten, um weitere Erkenntnisse darüber zu gewinnen, wie Sars-CoV-2 die Zelle zu eigenen Gunsten manipuliert.