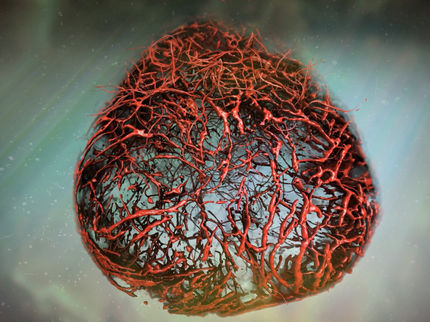
Mittelhirn-Organoide für automatisierte Wirkstoff- und Krankheitsforschung
Max-Planck-Innovation lizenziert Verfahren zur Erzeugung organähnlicher Gewebe-Aggregate an Biotech-Unternehmen StemoniX
Bis ein einziger wirksamer Arzneistoff gefunden ist, müssen manchmal hunderttausende Wirkstoffe in großen vollautomatisierten Experimenten getestet werden. Die meisten davon funktionieren nicht wie gewünscht oder sind sogar toxisch. Seit der Entwicklung der induzierten pluripotenten Stammzelltechnologie (iPS-Zell-Technologie) im Jahre 2006 können Forschende Stammzellen aus Hautbiopsien oder Blutproben herstellen. Um im Labor möglichst physiologische Bedingungen zu erhalten, erzeugen viele Forscher mit der iPS-Zell-Technologie dreidimensionale organähnliche Gewebe-Aggregate (Organoide). Nun ist es einem Wissenschaftlerteam am Max-Planck-Institut für molekulare Biomedizin in Münster gelungen, mit menschlichen Zellen völlig automatisiert Mittelhirn-Organoide herzustellen, die im Hochdurchsatzverfahren erzeugt, kultiviert und im Detail analysiert werden können. Die Technologietransfer-Gesellschaft Max-Planck-Innovation hat dieses Verfahren nun an das amerikanische Biotech-Unternehmen StemoniX lizenziert.

Mit einem Laborroboter wie diesem können Organoide standardisiert und in großer Zahl produziert werden. Pro Tag können die Forscher bis zu 20.000 Gehirn-Organoide erzeugen und gleichzeitig versorgen und testen. Zum Vergleich: Manuell lassen sich maximal ein paar Hundert Organoide pro Tag versorgen – die sich zudem stark voneinander unterscheiden und daher nicht für Medikamententests geeignet sind.
Max Planck Institute for Molecular Biomedicine | Jan Bruder
Für die sehr zeit- und kostenintensive Wirkstoffforschung stellt die iPS-Zell-Technologie eine ideale Lösung dar. Induzierte pluripotente Stammzellen werden im Labor aus Hautzellen, zum Beispiel eines Parkinson-Patienten, erzeugt. Diese iPS-Zellen lassen sich in Kultur unendlich vermehren und können zu allen Zelltypen des Körpers umgewandelt werden. Aus iPS-Zellen lassen sich so patientenspezifische Zelllinien gewinnen, die als Krankheitsmodelle dienen können. Das ist vor allem für Erkrankungen interessant, für die es keine geeigneten Tiermodelle gibt, wie z. B. die Parkinson-Krankheit.
Um die Krankheit in der Kulturschale möglichst gut abzubilden, setzen Wissenschaftler schon seit einigen Jahren auf drei-, statt zweidimensionale Kultursysteme, weil 3D-Systeme der zellulären Vielfalt und deren komplexer Struktur und Interaktionen in Organen viel näher kommen. Eine Art davon sind Organoide. „Organoide wachsen und reifen auf eine selbst-organisierende Weise aus iPS-Zellen oder gewebespezifischen Vorläuferzellen zu einem Gewebe-Aggregat, wie es auch im menschlichen Körper passieren würde,“ erklärt Jan Bruder, Wissenschaftler am Max-Planck-Institut für molekulare Biomedizin und Verantwortlicher der Studie. „Dadurch, dass sich die Zellen in Organoiden selbst organisieren, sind Organoide komplexer, ahmen die charakteristischen physiologischen Eigenschaften des Gewebes besser nach und bieten daher verschiedene funktionelle Vorteile gegenüber traditionellen Modellen.“
Noch werden Organoide zum großen Teil individuell und per Hand hergestellt, sind also nicht für Hochdurchsatzverfahren geeignet. Das führt einerseits zu beträchtlichen verfahrensbedingten Abweichungen zwischen einzelnen Organoiden, andererseits verhindert es die effiziente Herstellung von Organoiden in Stückzahlen, die für die Arzneimittelforschung gebraucht werden.
Die Max-Planck-Forscher machten nun bedeutende Fortschritte bei der Erzeugung und Analyse von Organoiden, welche ihre Entdeckungen für den Einsatz in groß angelegten Forschungsvorhaben wie der Hochdurchsatz-Wirkstoffentwicklung nutzbar machen.
Zunächst wurde eine Strategie entwickelt, bei der Organoide mit Mittelhirn-Identität aus sogenannten ‚small molecule‘ neuralen Vorläuferzellen (‚small molecule neural precursor cells‘ - smNPCs) erzeugt wurden. Diese Zellen sind in der Lage die für die Mittelhirn-Organoide relevanten Zelltypen schneller und mit größerer Reproduzierbarkeit als derzeitige Methoden zu generieren. Von besonderer Bedeutung ist die Erzeugung von dopaminproduzierenden Neuronen Neuronen innerhalb der Organoide, da dies genau die Nervenzellen sind, die im Gehirn von Parkinson-Patienten zuerst absterben.
„Anstatt Mittelhirnneurone über ein bis zwei Monate hinweg aus iPS-Zellen heranzuzüchten haben wir smNPCs benutzt. Auf diese Weise haben wir Dopamin-produzierende Nervenzellen innerhalb von zwei Wochen erhalten,“ sagt Henrik Renner, Erstautor der Studie und Doktorand am Max-Planck-Institut für molekulare Biomedizin.
Der zweite Fortschritt des Forscherteams war, dass die Organoidproduktion mit automatisierten Pipettierrobotern durchgeführt werden kann, um große Mengen von Organoiden aus den smNPCs auf eine reproduzierbare Art und Weise herzustellen.
Die Ergebnisse waren erfreulich und vielversprechend: „Die Mittelhirn-Organoide aus smNPCs sind nicht nur untereinander sehr homogen,“ sagt Henrik Renner, „sie weisen auch signifikante Merkmale des menschlichen Mittelhirns auf und zeigen aggregatweit spontane, synchronisierte neurale Aktivität, ähnlich wie man sie auch in der frühen Entwicklung des menschlichen Nervengewebes findet.“
Die dritte Verbesserung für ein effizienteres Anwendungsverfahren war die Automatisierung der Analyse. Auch hier hat das Forscherteam konsequent auf Robotik gesetzt: „Wir haben ein Protokoll entwickelt, mit dem wir die Organoide automatisiert in ihrer Gesamtheit untersuchen können. Der Trick dabei ist, dass Zielproteine im ganzen Organoid mit Antikörpern markiert und diese Färbungen im Fluoreszenzmikroskop automatisch in 3D erfasst werden,“ sagt Henrik Renner.
Der Vorteil dieses Verfahrens: einzelne Zell-Subtypen können – in einem hochdurchsatz-kompatiblen System – im intakten Organoid ausgemessen werden. Hiermit können nun erstmals Arzneimittelwirkungen auf Einzelzellebene innerhalb einer komplexen 3D-Zellumgebung in einem vollautomatischen Hochdurchsatz-Arbeitsablauf beurteilt werden. „Die Verknüpfung von Herstellung und Analyse von Organoiden in ein und demselben Kulturformat, in dem alle Schritte übergangslos ineinandergreifen, ist ein enormer Fortschritt,“ betont Jan Bruder. Die Forschung wurde durch einen Advanced Grant an Hans Schöler im Rahmen des ERC-Programms ‚Horizon 2020‘ finanziert.
Verfahren lizenziert
Max-Planck-Innovation hat dieses Verfahren nun an das amerikanische Biotech-Unternehmen StemoniX lizenziert. StemoniX entwickelt auf iPS-Zellen basierende 3D microOrgan®-Gewebekonstrukte, Krankheitsmodelle und fortschrittliche Analysemethoden, um sicherzustellen, dass nur die sichersten und wirksamsten Verbindungen durch die Forschungspipelines ihrer Biopharma-Partner weiterentwickelt werden.
Durch die Kombination der vom MPI lizenzierten Verfahren zur automatisierten Herstellung und Analyse von extrem homogenen Organoiden des menschlichen Mittelhirns erweitert StemoniX seine microBrain®-Plattform auf das menschliche Mittelhirn.
„Die neuen Technologien zur Erzeugung von Organoiden mit Mittelhirn-Identität passen perfekt zu unserem ‚Human-First‘-Ansatz in der Medikamentenentwicklung und zu unserer Fähigkeit, hoch reproduzierbare und physiologisch relevante iPS-Zell-basierte Modelle in Massenproduktion herzustellen“, sagt Ping Yeh, Mitbegründer und CEO von StemoniX.
„Wir haben bereits die klinische Relevanz von microBrain 3D bei der Früherkennung von Neurotoxizität sowie dessen Fähigkeit zur schnellen Entdeckung und Stratifizierung neuer Targets und potenzieller Therapeutika für Krankheiten wie das Rett-Syndrom nachgewiesen. Die Integration der Biologie des Mittelhirns und damit verbundener Krankheitsmodelle für Erkrankungen wie Parkinson in unsere Technologie von microBrain und AnalytiX™ wird die Biopharma-Pipelines stärken und die Entwicklung von Therapeutika für eine Vielzahl verheerender Krankheiten beschleunigen.“
Leonie Mönkemeyer, Patent- und Lizenzmanagerin bei Max-Planck-Innovation, fasst zusammen: "Wir freuen uns, dass StemoniX unsere wissenschaftlichen Entdeckungen vorantreibt. Durch die Kombination unserer jeweiligen Technologien kann die Suche nach Therapeutika für mehrere neurologische Erkrankungen bereits in einem frühen Stadium auf einen engeren Pool von Kandidaten beschränkt werden, indem Wirksamkeit und unerwünschte Nebenwirkungen lange vor den klinischen Phasen der Medikamentenentwicklung bestimmt werden. Der Einsatz dieser Modelle in der Arzneimittelentwicklung hat das Potenzial, die Zahl der neu zugelassenen und wirksamen Medikamente weiter zu erhöhen und die Entwicklungszyklen deutlich zu verkürzen, was jährlich vielen Patienten zugutekommen könnte."
Originalveröffentlichung
Henrik Renner, Martha Grabos, Katharina J Becker, Theresa E Kagermeier, Jie Wu, Mandy Otto, Stefan Peischard, Dagmar Zeuschner, Yaroslav TsyTsyura, Paul Disse, Jürgen Klingauf, Sebastian A Leidel, Guiscard Seebohm, Hans R Schöler, Jan M Bruder; "A fully automated high-throughput workflow for 3D-based chemical screening in human midbrain organoids"; eLife; 2020;9:e52904.