Bakterien unter Stress
Bakterielle Abwehrmechanismen im Detail verstehen
Bakterien nutzen in Stresssituationen spezielle Ionenkanäle zur Abwehr. Deren Funktionsweise zu verstehen liefert die Grundlage um schädliche Bakterien bekämpfen zu können. Wie zwei von diesen Kanälen aufgebaut sind und sich öffnen konnte nun eine Würzburger Forschungsgruppe in Kooperation mit der ETH Zürich und der University of Oxford entschlüsseln.
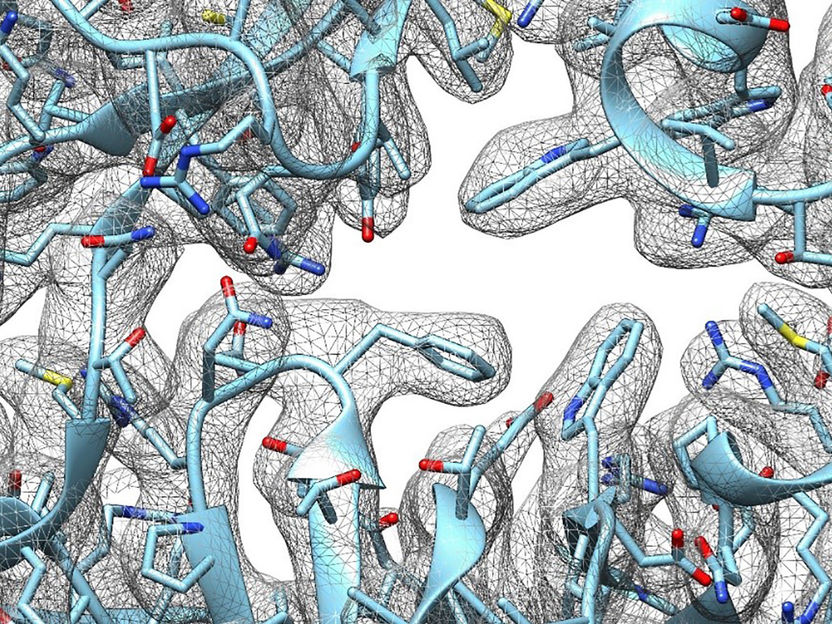
Die Abbildung zeigt einen Ausschnitt aus der Struktur des bakteriellen mechanosensitiven Kanals YnaI. Zu sehen ist ein Portal, das Salzionen passieren müssen.
AG Boettcher, RVZ
Wenn es zu regnen anfängt, kann das für Bakterien eine gefährliche Situation sein. Durch die sinkenden Salzkonzentrationen in der Umgebung strömt Wasser zum Ausgleich in die Zelle mit der höheren Ionenkonzentration und bringt die Zelle zum Platzen. Als Abwehrmechanismus besitzt das Bakterium Escherichia coli ganze sieben unterschiedliche Sorten von Kanälen in der Zellmembran. Diese Kanäle funktionieren wie Türen und können Ionen in die Zelle hinein, oder aus der Zelle heraus schleusen.
Den genauen molekularen Aufbau von zwei weiteren dieser Kanäle mithilfe von Elektronen-Kryomikroskopie zu entschlüsseln, das gelang nun der Forschungsgruppe von Prof. Bettina Böttcher vom Rudolf-Virchow-Zentrum – Center for Integrative and Translational Bioimaging der Universität Würzburg in einer internationalen Kooperation mit den Gruppen von Prof. Rainer Hedrich der Universität Würzburg, Prof. Mark Sansom von der University of Oxford und Prof. Renato Zenobi von der ETH Zürich.
Durch die Kenntnis der hochaufgelösten Strukturen können die Wissenschaftler zum einen die verschiedenen Kanäle unterscheiden und zum anderen besser verstehen wie genau der Öffnungsmechanismus, also die „Türklinke“ funktioniert. „Nur, wenn wir bakterielle Abwehrmechanismen im Detail verstehen, können wir erfolgreich pathogene Bakterien bekämpfen.“, betont Böttcher. „Außerdem sind mechanosensitive Kanäle auch an anderen wichtigen biologischen Funktionen beteiligt, wie zum Beispiel Blutdruckregulation und Hören. Deren grundlegende Mechanismen sind aber bisher nur unzureichend erforscht. Deswegen ist Grundlagenforschung hier so wichtig.“, ergänzt Dr. Tim Rasmussen, der als Postdoktorand in der Arbeitsgruppe Böttcher forscht.
Originalveröffentlichung
Meistgelesene News
Originalveröffentlichung
Vanessa Judith Flegler, Akiko Rasmussen, Shanlin Rao, Na Wu, Renato Zenobi, Mark S.P. Sansom, Rainer Hedrich, Tim Rasmussen and Bettina Böttcher; "The mechanosensitive MscS-like channel Ynal has a gating mechanism based on flexible pore helices"; PNAS (November 2020)
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Analytik- und Labortechnik-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.