Hunderte von Proteinen parallel untersuchen
Erste hochskalierbare Methode zur Untersuchung der Proteinlevel und Proteinlokalisierungen in Zellen entwickelt
Forscher des CeMM haben nun eine hochskalierbare Methode entwickelt, die es erlaubt, Hunderte von Proteinen parallel zu untersuchen, um die Veränderungen ihrer Mengen und Lokalisierungen in der Zelle zu verfolgen. Diese neuartige Strategie kann beispielsweise verwendet werden, um die Auswirkungen von Wirkstoffkandidaten auf zahlreiche Proteine in der Zelle zu beobachten und stellt somit einen wesentlichen Beitrag zur Entwicklung und Charakterisierung von Medikamenten gegen Krankheiten wie Krebs dar..
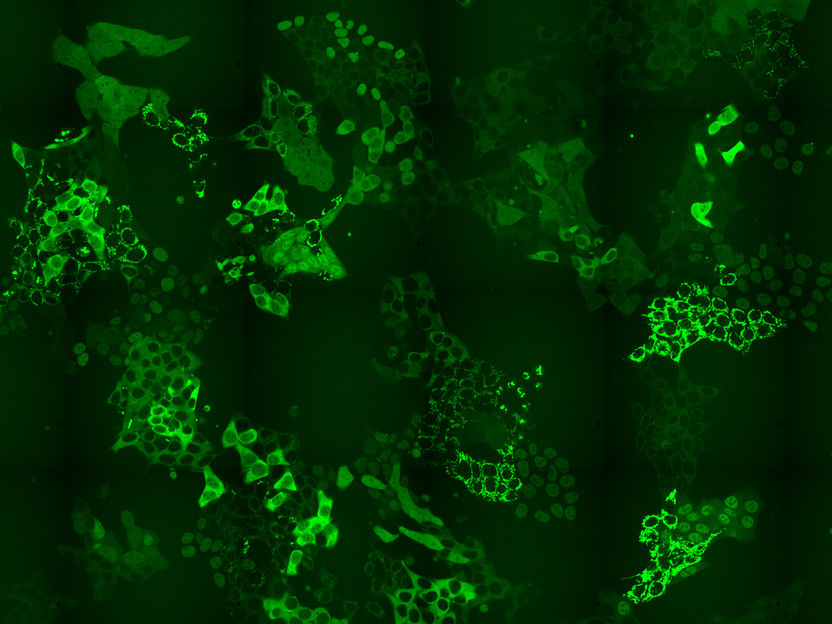
Zellpool mit hunderten, GFP-markierten Proteinen
Andreas Reicher
Proteine sind große Moleküle in der Zelle, die für Struktur und Funktion von Gewebe und Organen im Körper erforderlich sind. Sie sind für fast alle Aufgaben des zellulären Lebens verantwortlich und können so vielfältig sein wie die Funktionen, die sie erfüllen. Die Mengen und Lokalisierungen von Proteinen innerhalb der Zelle steuern wichtige Aspekte vieler zellulärer Prozesse und können als Ziele für die Entwicklung von Medikamenten fungieren.
Traditionell verwenden Wissenschaftler eine Fluoreszenzmarkierung, um einzelne Proteine zu markieren und ihre Rolle in der Zelle zu untersuchen. Diese Methode erlaubt es, zum Beispiel die Effekte verschiedener Medikamentendosierungen auf ein einzelnes Protein zeitaufgelöst zu untersuchen.
Andreas Reicher und Anna Koren aus der Gruppe von CeMM-Principal Investigator Stefan Kubicek haben eine neuartige Strategie entwickelt, die es zum ersten Mal erlaubt, Veränderungen in einer sehr hohen Anzahl von Proteinen parallel zu beobachten und zu charakterisieren. Mit dieser Methode können nicht nur die Wirkungen bestimmter bekannter Medikamente in den Zellen beschrieben und besser verstanden werden, sondern auch neue Wirkstoffe entdeckt werden, die durch Beeinflussung der Proteinspiegel oder -lokalisationen in den Zellen wirken.
Beschleunigung bei Entwicklung von Medikamenten
Die CeMM-Forscher entwickelten eine CRISPR-Cas9 basierende Intron-Markierungsstrategie, um Zellpools zu erzeugen, die Hunderte von markierten Proteinen enthielten, wobei in jeder Zelle ein anderes Protein mit GFP markiert wurde. Diese Zellpools wurden nun niedermolekularen Substanzen wie einem Molekül zum chemischen Abbau von BRD4 sowie dem zugelassenen Krebsmedikament Methotrexat ausgesetzt. Die Forscher beobachteten dann mithilfe der Zeitraffermikroskopie, ob es als Reaktion auf die angewandte Behandlung zu Veränderungen in der Konzentration oder subzellulären Lokalisierung der markierten Proteine in irgendeiner der Zellen im Pool kam. Die von ihnen angewandte Markierungsstrategie ermöglichte es ihnen dann, mithilfe von In-situ-Sequenzierung festzustellen, welche der hunderten Proteine im Zellpool die Lokalisierung veränderten. Auf diese Weise konnten sie sowohl erwartete als auch bisher unbekannte Auswirkungen dieser Substanzen auf die Abundanz und Lokalisation einzelner Protein feststellen.
„Unsere Studie beschreibt eine Technologie, die nicht nur zum ersten Mal Intron-Markierung auf einen Genpool anwendet, sondern auch in allen drei Schritten – Intron-Markierung, zelluläre Bildgebung und In-situ-Sequenzierung – deutlich optimiert wurde. Diese Methode kann auf chemische Bibliotheken und Kandidatenmoleküle angewandt werden, um Wirkstoffe zu entwickeln und umfassend zu charakterisieren. Dadurch kann die Entwicklung von Medikamenten mit neuartigen Wirkmechanismen, wie der Induktion des chemischen Proteinabbaus und der Veränderung von Protein-Protein-Interaktionen, beschleunigt werden. Zudem wird die neue Strategie auch großen Einfluss auf die Untersuchung der globalen und subzellulären Proteomdynamik haben“, erklärt Stefan Kubicek.
Originalveröffentlichung
Diese Produkte könnten Sie interessieren
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Proteinanalytik
Die Proteinanalytik ermöglicht einen tiefen Einblick in diese komplexen Makromoleküle, ihre Struktur, Funktion und Wechselwirkungen. Sie ist unerlässlich für die Entdeckung und Entwicklung von Biopharmazeutika, das Verständnis von Krankheitsmechanismen und die Identifizierung von therapeutischen Zielen. Durch Techniken wie Massenspektrometrie, Western Blot und Immunoassays können Forscher Proteine auf molekularer Ebene charakterisieren, ihre Konzentration bestimmen und mögliche Modifikationen identifizieren.

Themenwelt Proteinanalytik
Die Proteinanalytik ermöglicht einen tiefen Einblick in diese komplexen Makromoleküle, ihre Struktur, Funktion und Wechselwirkungen. Sie ist unerlässlich für die Entdeckung und Entwicklung von Biopharmazeutika, das Verständnis von Krankheitsmechanismen und die Identifizierung von therapeutischen Zielen. Durch Techniken wie Massenspektrometrie, Western Blot und Immunoassays können Forscher Proteine auf molekularer Ebene charakterisieren, ihre Konzentration bestimmen und mögliche Modifikationen identifizieren.