Neuartiger „An/Aus“-Schalter in Proteinen entdeckt
„Ich habe meinen Augen nicht getraut, als ich die Struktur des neuartigen Schalters zum ersten Mal sah“
Proteine erfüllen in der Zelle eines jeden Lebewesens eine Vielzahl von Funktionen und spielen bei fast allen biologischen Prozessen eine entscheidende Rolle. Sie steuern nicht nur den Stoffwechsel, die zelluläre Signalübertragung und die Energieproduktion, sondern sind als Antikörper auch die Frontarbeiter unseres Immunsystems im Kampf gegen Krankheitserreger wie das Coronavirus. Angesichts dieser wichtigen Aufgaben ist es nicht verwunderlich, dass die Aktivität der Proteine streng kontrolliert wird. Es gibt zahlreiche chemische Schalter, die die Struktur und damit die Funktion von Proteinen als Reaktion auf wechselnde Umweltbedingungen und Stress steuern. Die biochemischen Strukturen und Funktionsweisen dieser Schalter glaubte man gut zu kennen. Umso überraschter war ein Forschungsteam der Universität Göttingen, als es einen völlig neuartigen, aber bisher übersehenen „An/Aus-Schalter“ entdeckte. Dieser scheint ein allgegenwärtiges regulatorisches Element in Proteinen in allen Bereichen des Lebens zu sein.
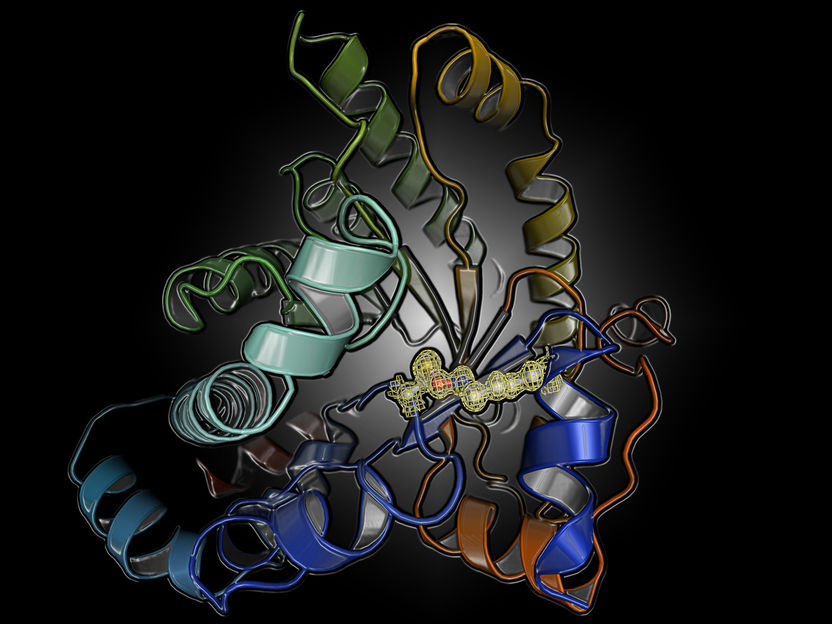
Proteinstruktur mit dem neuartigen Schalter zwischen einem Cystein- und einem Lysinrest.
Kai Tittmann
Die Forscher untersuchten ein Protein aus dem menschlichen Erreger Neisseria gonorrhoeae, der Gonorrhoe verursacht, eine bakterielle Infektion mit über 100 Millionen Fällen weltweit. Diese Krankheit wird typischerweise mit Antibiotika behandelt, doch die zunehmende Antibiotikaresistenz stellt eine ernsthafte Bedrohung dar. Um neue Behandlungsmöglichkeiten zu finden, untersuchte das Team die Struktur und den Mechanismus eines Proteins, das eine Schlüsselrolle im Stoffwechsel des Erregers einnimmt. Überraschenderweise kann das Protein durch Oxidation und Reduktion ein- und ausgeschaltet werden – bekannt als „Redox-Schalter“. Die Wissenschaftler vermuteten, dass dies durch einen häufig vorkommenden und gut bekannten „Disulfidschalter“ zwischen zwei Cystein-Aminosäuren verursacht wird. Als sie am Teilchenbeschleuniger DESY in Hamburg die Röntgenstrukturen des Proteins im „An“- und „Aus“-Zustand entschlüsselten, erlebten sie eine noch größere Überraschung: Die chemische Natur des Schalters war völlig unbekannt. Er wird zwischen einer Lysin- und einer Cystein-Aminosäure mit einem verbrückenden Sauerstoffatom gebildet.
„Ich habe meinen Augen nicht getraut, als ich die Struktur des neuartigen Schalters zum ersten Mal sah“, sagt Prof. Dr. Kai Tittmann von der Universität Göttingen, der die Studie leitete. „Wir dachten zunächst, dass sich dieser künstlich als Nebenprodukt des experimentellen Prozesses gebildet haben muss, da diese chemische Einheit unbekannt war.“ Doch zahlreiche Wiederholungen der Experimente lieferten immer das gleiche Ergebnis. Eine Analyse der Proteinstrukturdatenbank offenbarte darüber hinaus, dass es noch viele andere Proteine gibt, die sehr wahrscheinlich diesen Schalter besitzen. Er war offenbar bei früheren Untersuchungen übersehen worden, da die Auflösung der Proteinstrukturanalyse nicht ausreichte, um ihn sicher zu erkennen. Die nun vom Team vermessenen Kristalle erlaubten es hingegen, die Proteinstruktur mit extrem hoher Auflösung zu bestimmen, so dass der neuartige Schalter sichtbar wurde. „Das umfangreiche Screening nach hochwertigen Proteinkristallen hat sich wirklich gelohnt, ich könnte nicht glücklicher sein“, sagt Marie Wensien, Erstautorin der Arbeit.
Das Team geht davon aus, dass die Entdeckung des neuartigen Proteinschalters zahlreiche Auswirkungen auf die Biowissenschaften haben wird, zum Beispiel auf dem Gebiet des Proteindesigns. Sie wird auch neue Wege für medizinische Anwendungen und die Entwicklung von Medikamenten eröffnen. Es ist bekannt, dass viele menschliche Proteine, die bei schweren Krankheiten eine Rolle spielen, redox-kontrolliert sind, und der neu entdeckte Schalter spielt wahrscheinlich auch bei der Regulierung ihrer biologischen Funktion eine zentrale Rolle.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Kjel- / Dist Line von Büchi
Kjel- und Dist Line - Wasserdampfdestillation und Kjeldahl-Anwendungen
Maximale Genauigkeit und Leistung für Wasserdampfdestillation und Kjeldahl-Anwendungen

AZURA Purifier + LH 2.1 von KNAUER
Präparative Flüssigkeitschromatografie - Neue Plattform für mehr Durchsatz
Damit sparen Sie Zeit und verbessern die Reproduzierbarkeit beim Aufreinigen

Holen Sie sich die Analytik- und Labortechnik-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte
Forscher enträtseln Dynamik von Elektronenwolken - Analyse zeigt überraschendes Doppelverhalten
























































