Glykierung im Körper: Auslöser für Proteinfehlfunktionen im Alter und bei altersassoziierten Erkrankungen
Studie zeigt eindrucksvoll, wie die Folgen der Glykierung für das gesamte Proteom untersucht werden können
Um Organfunktionen aufrechtzuerhalten, müssen Proteinfunktionen in Zellen aufeinander abgestimmt und im Gleichgewicht gehalten werden. Mit zunehmendem Alter ist diese Balance gestört. Eine mögliche Ursache dafür ist eine Glykierung, bei der sich Zucker und Proteine irreversibel miteinander verbinden. Die Endprodukte der Glykierung (AGEs) reichern sich an und können zu Entzündungen und Schäden führen. Ein Forscherteam vom Leibniz-Institut für Alternsforschung – Fritz-Lipmann-Institut (FLI) und Universitätsklinikum Jena (UKJ) hat untersucht, wo AGEs in der Zelle entstehen, welchen Einfluss sie auf Proteine haben und ob sie zu altersassoziierten Erkrankungen und zum Altern beitragen.
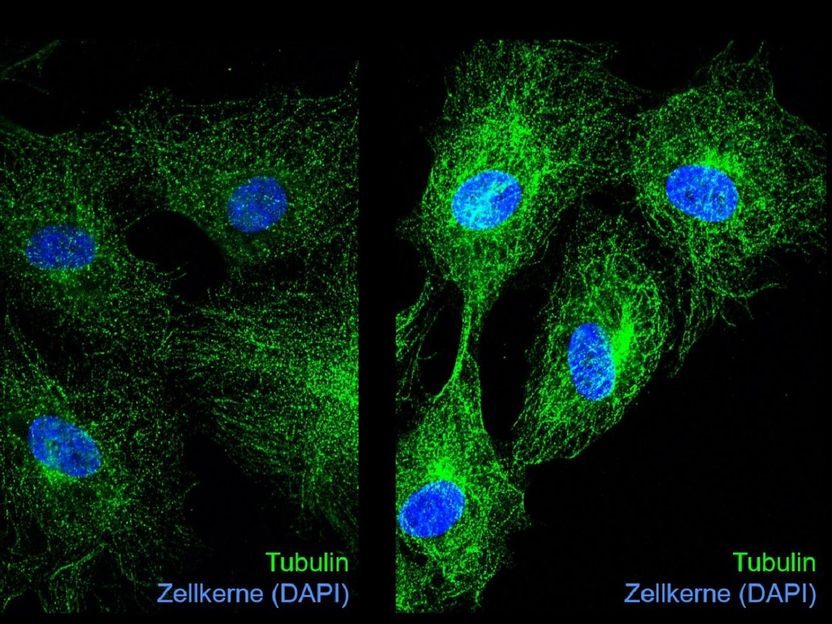
Immunfluoreszenzaufnahmen von Tubulin (grün) und Zellkernen (blau) in unbehandelten (links) und Glyoxal-behandelten Endothelzellen (rechts). Die Glykierung von Tubulin durch Glyoxal führt zu veränderter Mikrotubuli-Dynamik und Hemmung der Zellteilung.
Institute of Molecular Cell Biology/ UKJ / Katrin Spengler
Die 1912 von dem französischen Biochemiker Louis Maillard beschriebene chemische Reaktion, bei der sich Zucker mit Proteinen verbinden, führt zur Entstehung von Molekülen, die nicht mehr abbaubar sind (Advanced Glycation End Products, AGEs). Dieser als „Maillard-Reaktion" bezeichnete Prozess scheint eine wichtige Rolle beim Alternsprozess zu spielen und zur Entstehung chronischer Krankheiten beizutragen. AGEs gelten beispielsweise als Risikofaktoren für Gefäßerkrankungen bei Diabetes mellitus und fördern die Versteifung der Blutgefäße. Die Glykierung betrifft verschiedene Proteine im Körper und kann die Funktionalität und Struktur der betroffenen Zellen und Gewebe beeinträchtigen. Der Vorgang der Glykierung wird daher zunehmend als eine potenziell treibende Kraft für Stoffwechselerkrankungen und Alternsprozesse angesehen.
Doch wo genau findet die Glykierung in der Zelle statt? Welche Auswirkungen hat sie auf das betroffene Protein und auf die Funktion der Zelle? Diesen und weiteren Fragen ist ein Forscherteam des Jenaer Leibniz-Instituts für Alternsforschung – Fritz-Lipmann-Institut (FLI) und des Universitätsklinikums Jena (UKJ) genauer nachgegangen. Die in der Fachzeitschrift „Nature Communications“ veröffentlichte Studie untersucht die pathophysiologischen Auswirkungen von AGEs auf intrazelluläre Proteine und ihren möglichen Beitrag zur Entstehung von Stoffwechselerkrankungen und Alterungsprozessen.
Glykierung von Proteinen
„Die nicht-enzymatische Glykierung von Proteinen durch ihre Reaktion mit Zuckern oder hochreaktiven Dicarbonylen, wie beispielsweise Glyoxal, nimmt zu, wenn der Glukosespiegel im Körper dauerhaft hoch ist“, berichtet Dr. Alessandro Ori, Forschungsgruppenleiter am FLI. Eines der am häufigsten vorkommenden AGEs ist N(6)-Carboxymethyllysin (CML), dessen Bildung u.a. durch Reaktion mit Glyoxal ausgelöst wird. „CML ist chemisch stabil und reichert sich im menschlichen Gewebe vor allem bei Krankheiten wie Diabetes mellitus und Atherosklerose, aber auch während des normalen Alterns an. CML kann daher als ein Biomarker für das Altern verstanden werden“, ergänzt Prof. Regine Heller vom Institut für Molekulare Zellbiologie, UKJ. Während die Glykierung von extrazellulären Proteinen wie Hämoglobin oder Kollagen gut beschrieben ist, ist über diese Modifikation in intrazellulären Proteinen bisher wenig bekannt.
Umfassender Ansatz zur Charakterisierung von CML-modifizierten Proteinen
Um die durch Glykierung verursachten Veränderungen der Proteine im gesamten Proteom nachweisen zu können, wurden zwei experimentelle Modelle eingesetzt. „Zum einen haben wir klassische Zellkulturen wie Fibroblasten und Endothelzellen verwendet, um den Einfluss der Glykierung von Proteinen zu untersuchen. Andererseits nutzten wir auch Zellen aus Organen junger und alter Mäuse, um den ganzheitlichen Einfluss der Glykierung auf die Funktion und Wirkungsweise von Proteinen abzuleiten", erklärt Dr. Ori das Vorgehen in dieser Proteomstudie.
Ein neu etablierter Arbeitsablauf, der auf der selektiven Anreicherung von CML-modifizierten Peptiden in Kombination mit Massenspektrometrie basiert, ermöglichte die umfassende Charakterisierung und Quantifizierung der Zielproteine und ihrer Stoffwechselwege. In beiden Modellen wurden Hunderte von spezifischen Glykierungsstellen erstmals nachgewiesen.
Glykierung in Abhängigkeit von Proteinumsatz und Proteinmenge
Unabhängig von ihrer Lokalisierung in bestimmten Kompartimenten der Zelle waren Proteine, die langsamer verstoffwechselt werden, mit größerer Wahrscheinlichkeit einer Glykierung ausgesetzt, als Proteine mit einem schnelleren Umsatz. „Proteine mit einer längeren Halbwertszeit wurden viel häufiger modifiziert", erklärt Dr. Ori das Ergebnis in beiden Modellen. Dies stimmt mit früheren Studien überein, in denen gezeigt wurde, dass sich AGEs vor allem in Geweben mit langsamem Proteinumsatz, wie Knorpel und Haut, anhäufen.
„Obwohl in beiden Modellsystemen Proteine über den gesamten dynamischen Bereich hinweg glykierte Stellen aufwiesen, korrelierte die Glykierung stark mit der Häufigkeit der Proteine. Das heißt, wenn die Proteine sehr häufig vorkamen, waren sie auch häufiger modifiziert“, fasst Dr. Ori zusammen. „Aus diesen Ergebnissen leiten wir ab, dass sowohl ein langsamer Umsatz als auch die Proteinmenge wichtige Schlüsselfaktoren für die Glykierung von Proteinen in den Zellen sind." Diese Daten entstanden im Rahmen der naturwissenschaftlichen Doktorarbeit von Simone Di Sanzo am FLI innerhalb des DFG-Graduiertenkollegs 2155 „Proteinmodifikationen: Schlüsselmechanismen des Alterns (ProMoAge)“.
Organspezifische Glykierung von Proteinen
„Um den Einfluss des Alterns auf die Glykierung von Proteinen zu untersuchen, wurden die Glykierungsstellen im Herzen, in der Niere und in der Leber von jungen und alten Mäusen quantifiziert und parallel dazu Veränderungen im gesamten Proteom der gleichen Organe analysiert", erklärt Dr. Ori. Aus dieser Kombination von Daten konnte abgeleitet werden, dass Glykierungsprozesse organspezifisch abzulaufen scheinen.
„Es wurden aber auch modifizierte Proteine, beispielsweise Histone, identifiziert, die in allen untersuchten Organen alter Mäuse nachweisbar waren“, ergänzt Prof. Heller. „Unsere Daten deuten darauf hin, dass einerseits Glykierungen weitgehend organspezifisch sind und dass andererseits das Ausmaß der Modifizierung bestimmter Proteine mit dem Altern zunimmt, was wahrscheinlich auf die geringere Menge und Aktivität von Enzymen zur Entgiftung hochreaktiver Dicarbonylverbindungen in alten Organen zurückzuführen ist."
Glykierung hemmt Zellteilung
„In Endothelzellen führte die Behandlung mit Glyoxal zur Hemmung des Zellzyklus, d.h. die Zellteilung wurde durch die Anhäufung von CML deutlich reduziert“, erklärt Dr. Katrin Spengler vom UKJ, die die Studie mit geleitet hat. Dies war teilweise auf eine veränderte Expression von Regulatoren des Zellzyklus zurückzuführen. Um besser zu verstehen, wie sich die Glykierung von Proteinen auf den Verlauf des Zellzyklus auswirkt, konzentrierten sich die Forschenden auf Tubuline, die unter anderem wichtige Regulatoren des Zellzyklus sind. Um ihre Aufgaben zu erfüllen, bilden Tubuline Filamente, die so genannten Mikrotubuli, die ständige Auf- und Abbauprozesse durchlaufen müssen.
„In Experimenten mit gereinigtem glykiertem Tubulin und der Untersuchung von Mikrotubuli in Glyoxal-behandelten Endothelzellen mittels Immunfluoreszenz fanden wir Veränderungen in der Dynamik der Mikrotubuli, die zum Teil die Hemmung der Zellteilung erklären können", so Dr. Spengler weiter. Die Glykierung von Tubulinen kann andere wichtige Modifikationen von Tubulinen wie die Acetylierung beeinträchtigen und dadurch den „Tubulin-Code" verändern, der die Funktion der Mikrotubuli bestimmt.
Verständnis der Rolle der Glykierung und ihrer Auswirkungen auf alternde Zellen
Diese Studie zeigt eindrucksvoll, wie die Folgen der Glykierung für das gesamte Proteom untersucht werden können, indem Massenspektrometrie-Analysen mit mechanistischen Untersuchungen in zellulären Systemen kombiniert werden. Die Analyse ermöglicht die Kartierung von Glykierungsstellen an Proteinen und zeigt auf, wie diese mit spezifischen zellulären Funktionen verknüpft sind. Dies trägt wesentlich zum besseren Verständnis der Frage bei, wie die Glykierung von Proteinen zum Altern und zu altersassoziierten Stoffwechselerkrankungen beiträgt.
„Wenn man über einen längeren Zeitraum hinweg pathophysiologischen Konzentrationen von Zuckern und hochreaktiven Dicarbonylverbindungen ausgesetzt ist, wie es bei älteren Menschen oder Diabetikern der Fall ist, kann die Glykierung von Tubulin und anderen Proteinen ein erstes Ereignis sein, das schrittweise zu einer Beeinträchtigung der Zellfunktionen und schließlich zur Dysfunktion von Organen führt", fassen die Forscher zusammen. Die Identifizierung spezifischer Glykierungsstellen und/oder des Ausmaßes der Glykierung könnte daher helfen, ein Risiko für spätere alternsbedingte Krankheiten zu erkennen.
Originalveröffentlichung
Diese Produkte könnten Sie interessieren
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Massenspektrometrie
Die Massenspektrometrie ermöglicht es uns, Moleküle aufzuspüren, zu identifizieren und ihre Struktur zu enthüllen. Ob in der Chemie, Biochemie oder Forensik – Massenspektrometrie eröffnet uns ungeahnte Einblicke in die Zusammensetzung unserer Welt. Tauchen Sie ein in die faszinierende Welt der Massenspektrometrie!
Themenwelt Massenspektrometrie
Die Massenspektrometrie ermöglicht es uns, Moleküle aufzuspüren, zu identifizieren und ihre Struktur zu enthüllen. Ob in der Chemie, Biochemie oder Forensik – Massenspektrometrie eröffnet uns ungeahnte Einblicke in die Zusammensetzung unserer Welt. Tauchen Sie ein in die faszinierende Welt der Massenspektrometrie!