Quantentanz von Elektronen in Molekülen
Wissenschaftler beobachten bewegte Ladungsdichte in Echtzeit
Einem internationalen Forschungsteam um DESY-Wissenschaftler Tim Laarmann ist es erstmals gelungen, die quantenmechanische Wanderung von Elektronen durch ein Molekül mit Echtzeitmessungen zu verfolgen. Die Beobachtungen mit DESYs brillantem Freie-Elektronen-Laser FLASH an einzelnen Molekülen der Aminosäure Glyzin sind im Fachblatt „Science Advances“ veröffentlicht. Eine genaue Kenntnis der Quanteneffekte bei der Bewegung von Elektronen auf molekularer Ebene kann unter anderem der Optimierung und der Neuentwicklung besserer Strahlentherapien gegen Krebs dienen.
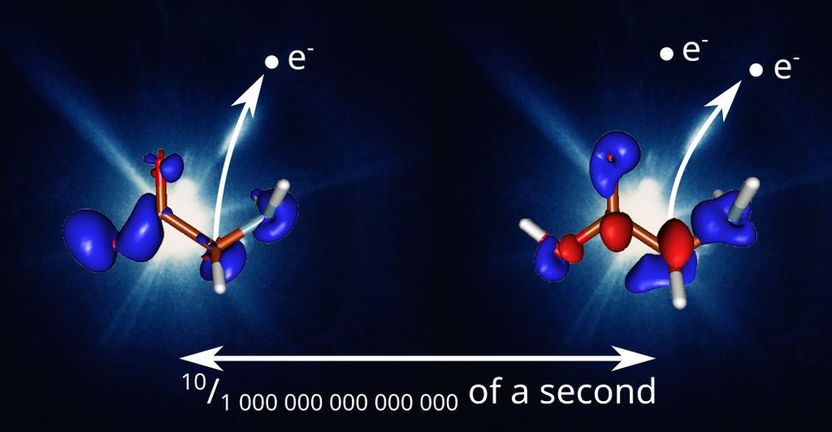
Im Experiment wird das Glyzin-Molekül zunächst durch den hochintensiven Röntgenpuls aus dem Freie-Elektronen-Laser FLASH ionisiert (links). Dies führt zu einer korrelierten Bewegung der Valenzelektronen und -löcher, die durch rote und blaue Keulen dargestellt werden. Nach einer variablen Zeitverzögerung von 0 bis 175 Femtosekunden hält ein weiterer Röntgenpuls den Zustand des Glyzin-Ions und die Elektronenbewegung fest, indem er das Ion weiter ionisiert und die resultierenden Ionisierungsprodukte gemessen werden (rechts). In diesem Beispiel ist eine Zeitverzögerung von 10 Femtosekunden dargestellt, die zwei Extrema der oszillierenden Elektronendichte zeigt, also eine halbe Periode der Elektronenkohärenz.
DESY, David Schwickert
„Die Aminosäure Glyzin ist ein häufig vorkommender Grundbaustein von Proteinen und spielt eine wichtige Rolle in Rezeptoren auf Zellmembranen und in Enzymen“, erläutert Laarmann. „Durch ihre kompakte Bauweise und ihre Tendenz Wasserstoffbrückenbindungen zu formen, erleichtert sie die sogenannte Proteinfaltung bei Reaktionen von Biomolekülen. Außerdem dient sie als Signal-Hemmer im zentralen Nervensystem.“ Glyzin ist auch bereits im Weltraum gefunden worden und ist dort ein Hinweis auf Grundbausteine außerirdischen Lebens. Ein wichtiger Untersuchungsaspekt ist daher die Reaktionsfreudigkeit der Moleküle in der rauen Umgebung des Weltalls: Wie isolierte Glyzin-Moleküle mit ionisierender Strahlung interagieren, ist eine Schlüsselfrage der Astrochemie.
Wenn energiereiche Strahlung auf ein Glyzin-Molekül trifft, wird oft eines seiner Elektronen aus dem Molekül herausgeschlagen. In dem dadurch entstehenden Glyzin-Ion beginnt die elektronische Ladung, sich umzuverteilen, was zunächst zu einem Hin- und Herschwingen der Ladungsdichte führt. Um Glyzin zu ionisieren, nutzte das Team die ultrakurzen Strahlungsblitze von FLASH, jeder kürzer als fünf Femtosekunden. Das sind fünf billiardstel Sekunden oder 0,000 000 000 000 005 Sekunden. „Mit diesen Blitzen und ausgeklügelten Datenverarbeitungsalgorithmen konnten wir eines der 40 Elektronen aus einem bestimmten Orbital des Glyzins quasi gezielt entnehmen“, berichtet Hauptautor David Schwickert von DESY, der zu diesem Projekt seine Doktorarbeit verfasst hat.
Anschließend nutzte das Team FLASH als Blitzlichtkamera, um Standbilder der Bewegung der elektronischen Ladung aufzunehmen. „Wir konnten zum ersten Mal die Elektronendynamik in diesem komplexen Aminosäuremolekül nach der Ionisation direkt in Echtzeit messen“, sagt Laarmann. Das Ergebnis ist ein 175 Femtosekunden langer Film, der die oszillierende elektronische Ladung und deren Einfluss auf die Bewegung der Atomkerne in dem Molekül zeigt. Während der anfängliche Knock-out des Elektrons zu einer positiven Ladung an einem bestimmten Atom führt, erzeugt die folgende Ladungsoszillation ein Kraftfeld, das schließlich auch die Kerne in Bewegung versetzt.
Quantenmechanisch betrachtet hinterlässt das davonfliegende Elektron das Molekül-Ion in einer sogenannten kohärenten Überlagerung von Eigenzuständen. Diese Kohärenz beeinflusst die Art und Weise, wie das Molekül chemisch reagiert. Dank der detaillierten Einblicke in dieses Quantenverhalten könnten sich Reaktionen von Biomolekülen künftig in gewünschter Weise steuern lassen. „Eine Voraussetzung für die Kontrolle der Elektronen- und Kerndynamik in Richtung spezifischer molekularer Reaktionswege ist eine detaillierte Analyse der Struktureigenschaften des Moleküls, wenn es aus dem Gleichgewicht gebracht wird“, erklärt Koautor Marco Ruberti vom Imperial College London, der zusammen mit einem Kollegen der Karls-Universität in Prag Vielelektronen-Simulationsrechnungen von Glyzin durchgeführt hat, „und hier insbesondere die Analyse und Kontrolle der zeitabhängigen elektronischen Struktur, welche die Potentialflächen bildet, in der sich die Atomkerne bewegen. In Übereinstimmung mit unseren Simulationen liefern die Glyzin-Experimente bei FLASH einen direkten Beleg für die Existenz langlebiger elektronischer Kohärenz in photoionisierten Biomolekülen.“
An den Forschungen waren Wissenschaftler von DESY, dem Imperial College London, der Karls-Universität Prag, der Universität Hamburg, der Universität Kassel, der Helmut-Schmidt-Universität in Hamburg, dem Helmholtz-Institut Jena, dem Helmholtz-Zentrum für Schwerionenforschung (GSI) in Darmstadt, der Friedrich-Schiller-Universität Jena und dem Helmholtz-Zentrum Berlin für Materialien und Energie beteiligt.
























































