Forschungsteam zeigt verborgene Wechselwirkungen von Partikeln an der Zelloberfläche
Ultraweiche Wechselwirkungen lassen sich durch Hochgeschwindigkeitsmessung und Frequenzanalyse nachweisen
Kann es sein, dass bei den meisten Messungen im Bereich der Lebenswissenschaften wichtige Wechselwirkungen im Zellinneren oder an der Zelloberfläche verborgen bleiben? Diese Frage beschäftigt ein Team um den Laser- und Bio-Physiker Prof. Dr. Alexander Rohrbach von der Universität Freiburg seit Jahren. Er und sein Mitarbeiter Dr. Felix Jünger untersuchen verschiedene Wechselwirkungen von Partikeln im Größenbereich von Bakterien, also wenige Mikrometer, und sogar von Viren, rund 0,1 Mikrometer, an verschiedenen Zelloberflächen. Mithilfe verfeinerter Lasermesstechnik und mathematischer Analysemethoden ist es ihnen nun gelungen, bisher verborgene Wechselwirkungen sichtbar zu machen. Die Ergebnisse sind in der Fachzeitschrift Small erschienen. Sie können künftig dazu beitragen, besser zu verstehen, wie verschiedene Partikel an Zellen binden – seien es Viren, Bakterien, Feinstaub, Zellreste oder mizellenumhüllte Wirkstoffe.
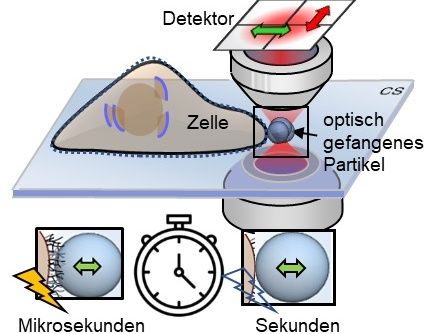
Mikrostrukturen wie die Glykokalyx an der Zelloberfläche kann man durch fluktuierende Partikel indirekt auf der Mikrosekundenskala messen, sie bleiben aber verborgen auf der Sekundenskala.
Alexander Rohrbach
Visko-Elastizität bestimmt Verhalten
Eine entscheidende Rolle für die Wechselwirkungen spielen die visko-elastischen Eigenschaften von Zelloberflächen. Als Beispiel nennt Rohrbach eine Stärkelösung: „Rührt man eine ausreichende Menge Maisstärke in eine Wasserwanne und geht darauf schnell, kann man tatsächlich auf der Flüssigkeit laufen. Man spürt nur einen elastischen Untergrund. Läuft man aber langsam oder bleibt stehen, so sinkt man ein und spürt die Flüssigkeit um die Füße.“ Je nach der wirkenden Zeitskala ist die Lösung also elastisch oder viskos. Der Betrachtende sieht entweder einen Läufer mit trockenen oder nassen Füssen aus der Wanne steigen.
Biologische Zellen bestehen aus kleinsten molekularen Strukturen, welche nur unter den besten Mikroskopen sichtbar werden. Sie alle reagieren bei Druck oder Zug teilweise elastisch, Energie wird also gespeichert, und teilweise viskos, Energie geht also verloren. Jede einzelne Zelle ist ein visko-elastisches System und bestimmt damit die visko-elastischen Eigenschaften etwa von Muskel- oder Bindegewebe. Fast jede Zelle hat eine eigene hochspezialisierte, extrazelluläre Matrix: ein Geflecht aus filamentartigen Molekülen, aus feinen Fasern und dünnen fingerartigen Ausstülpungen. Diese komplexe Zelloberfläche beeinflusst die Aufnahme von Partikeln wie Viren, Bakterien oder Feinstaub. „Die extrazelluläre Matrix unterscheidet bei der Signalweiterleitung nicht nur nach Größe und Form und Oberfläche der Partikel, sondern auch, wie schnell oder langsam thermisch diffundierende Partikel an die Oberfläche stoßen. Das heißt, sie fungiert als räumliches und zeitliches Sieb für mechanische Signale“, erläutert Rohrbach.
Superschnelle Messtechnik
Mit einem sogenannten photonischen Kraftmikroskop, einer Kombination aus optischer Laserpinzette und einem interferometrischen 4-Quadranten-Detektionssystem führte Bio-Physiker Jünger in zahlreichen Experimenten zunächst ein Mikrometer kleine Kügelchen an lebende Zellen heran. Das als Sonde dienende Partikel ist dabei im Laserfokus gefangen, macht aber dennoch kleine Zitterbewegungen, sogenannte thermische Positionsfluktuationen. Diese Bewegungen werden dreidimensional eine Million Mal pro Sekunde gemessen – und das bei einer Präzision von wenigen Nanometern. Die verrauscht aussehenden Positionssignale des Partikels enthalten jedoch entscheidende Informationen über die Wechselwirkung mit seiner Umgebung.
Führt man nun das Partikel mit der optischen Pinzette langsam an die Zelloberfläche heran oder präsentiert das Partikel der Zelle in kurzer, konstanter Distanz, so beginnt nach wenigen Sekunden eine Wechselwirkung des Partikels mit den feinen Strukturen der extrazellulären Matrix. Schaut man sich das Positionshistogramm an, also eine Verteilung aller Partikelpositionen, so stellt man praktisch keinen Unterschied in der Verteilung vor und nach der Wechselwirkung fest. Die Wechselwirkung ist verborgen. „Durch die schnelle Signalabtastung konnten wir erstmalig Kramers-Kronig-Integraltransformationen für thermische Partikelfluktuationen durchführen, die es erlauben, das elastische und das viskose Verhalten von Zellstrukturen auf verschiedenen Bewegungsfrequenzen darzustellen“, erklärt Jünger. Rohrbach ergänzt: „Um diesen beiden Frequenzverläufen jedoch eine Bedeutung zu geben, muss man seine Vorstellung der molekularen Geschehnisse in mathematische Gleichungen verpacken und dann abgleichen, wie gut die Lösungen dieser Gleichungen mit den experimentellen Ergebnissen übereinstimmen.“
Mathematisches Minimalmodell im Frequenzraum
Hierbei erdachten sich die Freiburger Forscher ein mathematisches Minimalmodell im Frequenzraum, welches sich unerwartet gut an das visko-elastische Verhalten bei verschiedenen Messmethoden an verschiedenen Zellen anpassen lässt. Durch die Analyse der Sondenfluktuationen konnten Jünger und Rohrbach beispielsweise wichtige Eigenschaften der perizellulären Matrix (PCM) bei Darm-Epithelzellen bestimmen, welche aus maschenartigen Hyaluronsäuresträngen besteht. „Wir konnten die Dicke der PCM von 350 Nanometer allein auf der Mikrosekundenskala messen, auf längeren Zeitskalen war die PCM schlicht unsichtbar“, sagt Rohrbach. Die Elastizität der PCM von nur circa sechs Pascal bei Millisekunden-Dynamiken, aber von circa 20 Pascal bei Mikrosekunden-Dynamiken könne beispielsweise erklären, warum kleine und hochdynamische Viren physikalisch gesehen von der PCM eher elastisch abprallen – größere und weniger dynamische Bakterien dagegen eher in die PCM einsinken, eben weil diese auf größeren Zeitskalen weniger elastisch ist.