Innovative Bioreaktor- und Kryotechnologien für bessere Wirkstofftests mit humanen Zellkulturen
Der effiziente und praxisnahe Einsatz von Zellkulturen in Toxizitäts- und Wirkstofftests wird ermöglicht
Viele Neuentwicklungen von medizinischen Wirkstoffen scheitern, weil trotz erfolgreicher Labortests mit Zellkulturen starke Nebenwirkungen bei Probanden auftreten. Dies kann passieren, wenn zum Beispiel die verwendeten Zellen aus tierischem Gewebe stammen. Speziell präparierte Zellkulturen aus menschlichem Gewebe, sogenannte hiPS-Zellen, ermöglichen zuverlässigere Tests und erhöhen damit die Erfolgsquote im Zulassungsverfahren. Fraunhofer-Forschende haben innovative Lösungen für die optimierte Herstellung von Zellen im Bioreaktor und einzigartige Kryotechniken entwickelt. Das ebnet den Weg für den effizienten und praxisnahen Einsatz der Zellkulturen in Toxizitäts- und Wirkstofftests.
Wenn in pharmazeutischen Studien beim Test neuer Wirkstoffe starke Nebenwirkungen bei den Probanden auftreten, stehen die Forschenden vor einem Dilemma. Oftmals muss dann die Entwicklung eines vielversprechenden Wirkstoffs abgebrochen werden und das geplante Medikament kommt nicht auf den Markt. Eine Ursache des Problems ist, dass die Wirkstoffe in der Regel mit In-vitro-Zellkulturmodellen auf Basis tierischer Zellen oder in Tierversuchen erprobt werden. In beiden Fällen lassen sich die Testergebnisse nur bedingt auf den Menschen übertragen. Dementsprechend gibt es ein Risiko, dass bei Probanden plötzlich intolerable Nebenwirkungen auftreten.
Große Hoffnungen setzt die Medizinforschung auf die humanen induzierten pluripotenten Stammzellen (hiPS-Zellen). Diese Zellen stammen aus menschlichem Gewebe und erlauben daher viel genauere Aussagen zur Wirkweise der Substanzen als herkömmliche Tests. Die Zellen entnimmt man zunächst dem menschlichen Hautgewebe oder einer Blutprobe und unterzieht sie im Labor einem speziellen Reprogrammierungsverfahren. Danach sind sie nicht mehr auf ein Gewebe festgelegt, daher der Begriff pluripotente Stammzellen. Für Wirkstofftests lassen sich die hiPS-Zellen anschließend wieder in nahezu alle Zelltypen des menschlichen Körpers entwickeln, also differenzieren. Das Risiko, dass in nachfolgenden klinischen Tests mit Menschen unerwünschte Nebenwirkungen auftreten, sinkt deutlich.
Bioreaktor für die hochskalierte Zellproduktion
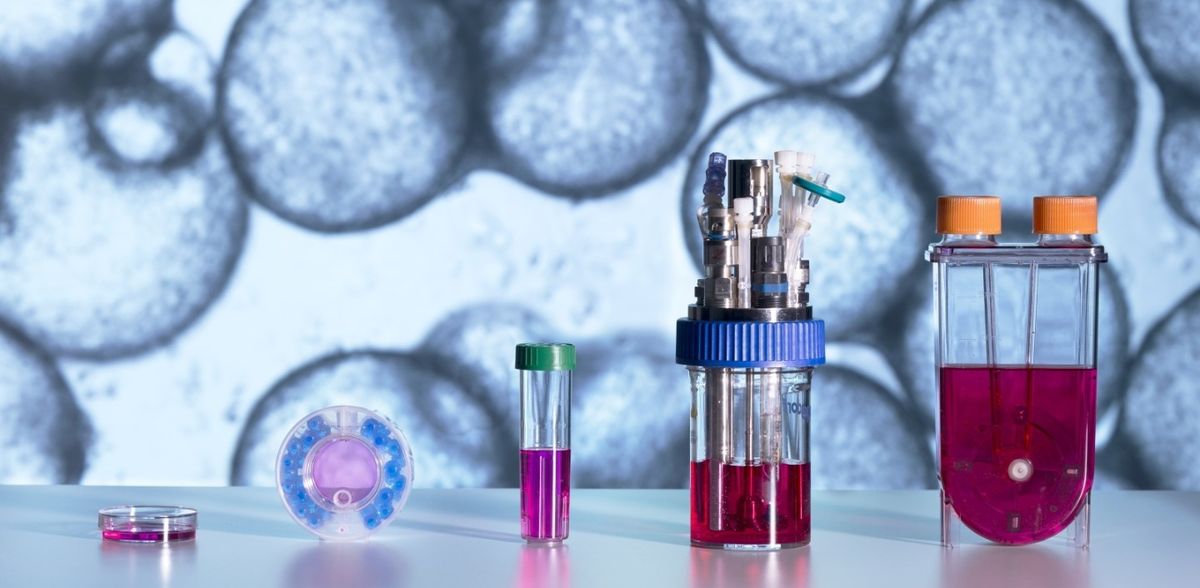
Die für die Tests erforderlichen Zellen werden in Bioreaktoren hergestellt. Einem Forschenden-Team um Dr. Julia Neubauer, Abteilungsleiterin Kryo- und Stammzelltechnologien am Fraunhofer-Institut für Biomedizinische Technik IBMT ist nun bei der Vermehrung und Differenzierung der hiPS-Zellen im Bioreaktor ein entscheidender Fortschritt gelungen. »Jetzt ist es erstmals möglich, den Prozess so hochzuskalieren, dass in kurzer Zeit große Mengen an funktionsfähigen Zellen entstehen«, sagt Neubauer.
Die Herausforderung für die Fraunhofer-Wissenschaftlerinnen und -Wissenschaftler im Gemeinschaftsprojekt »R2U-Tox-Assay« bestand darin herauszufinden, wie die natürlichen Umgebungsbedingungen im menschlichen Körper am besten im Bioreaktor reproduziert werden können, sodass die Zellen sich schnell vermehren, ohne ihre Funktionsfähigkeit einzubüßen. »Speziell für den Bioreaktor haben wir ein elastisches Hydrogel als Träger entwickelt und selbst hergestellt. Darauf fühlen sich die Zellen besonders wohl und können sich gut vermehren. Mit den gewählten Parametern sind wir in der Lage, für Medizintests relevante Mengen von bis zu mehreren Milliarden Zellen herzustellen«, erklärt Neubauer.
Mit den so gewonnenen Zellmodellen, die in Gewebe wie Herzmuskel, Haut oder Nervenzellen differenziert werden können, lassen sich die Assays für die Erprobung und Toxizitätsprüfung medizinischer Wirkstoffe ausstatten. Ein weiterer Vorteil: Da es sich bei den hiPS-Zellen um menschliche Zellen handelt, die noch die Genom-Informationen des Spenders enthalten, ist es möglich, auch für genetisch bedingte Erkrankungen entsprechende Tests neuer Wirkstoffe aufzusetzen.
Blitzkühlung im Kryotank
Ein weiteres Problem für die pharmazeutische Forschung oder Universitätskliniken ist allerdings die Lagerung und Verfügbarkeit von Zellkulturen. Hier haben die Fraunhofer-Forschenden ihre jahrzehntelange Expertise bei der Kryokonservierung von Zellen genutzt.
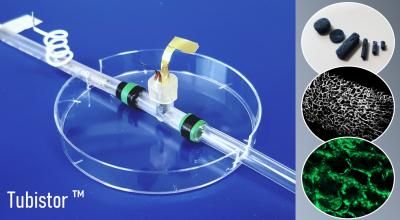
Die Kryokonservierung am Fraunhofer IBMT ist weltweit einzigartig. Die im Bioreaktor gewachsenen Zellmodelle werden mithilfe von flüssigem Stickstoff innerhalb von zwei Sekunden von etwa plus 23 auf minus 196 Grad Celsius gekühlt. Die Fraunhofer-Forschenden haben darüber hinaus eine spezielle Zellkulturplatte entwickelt, in der die Zellen zunächst kultiviert und anschließend eingefroren werden können. In Kombination mit dem schnellen Abkühlvorgang verhindern spezielle Einfriermedien die Bildung von Eiskristallen im Zellgewebe. Diese würden das Material beschädigen und in Matsch verwandeln. »Den unschönen Effekt kennen alle, die schon einmal Erdbeeren ins Tiefkühlfach gelegt haben«, schmunzelt Neubauer.
Für die Beschreibung der korrekten Prozedur hat die Fraunhofer-Expertin Neubauer mit ihrem Team ein detailliertes Kryoprotokoll erstellt. Es legt Parameter wie Kühlgeschwindigkeit und Einwirkzeiten der Einfriermedien für die jeweils zu konservierenden Zellen fest. Das Protokoll garantiert, dass die empfindlichen humanen Zellkulturen nach der Entnahme aus dem Kryobehälter und dem anschließenden Auftauen voll funktionsfähig sind. In diesen standardisierten Zellkulturplatten sind die Zellkulturen nahezu unbegrenzt lager- und transportfähig für die Hochdurchsatzscreenings der Pharmaforschung. Kliniken und pharmazeutische Labore können Zellkulturen bevorraten und haben bei Toxizitäts- und Wirkstofftests jederzeit die passenden Zellen zur Verfügung.
Bessere Wirkstofftests für neue Medikamente
Mit den weiterentwickelten Konzepten für Bioreaktor und Kryobehälter wird der Weg frei für den effizienten und praxisnahen Einsatz der hiPS-Zellen in der medizinischen Forschung. Die klassischen In-vitro-Tests mit tierischen Zellen sowie die ethisch problematischen Tierversuche werden abgelöst durch deutlich präzisere Testsysteme. »Insgesamt ermöglichen die Errungenschaften von R2U-Tox-Assay die effizientere und sichere Entwicklung von medizinischen Wirkstoffen für die Behandlung einer Reihe von Krankheitsbildern, darunter etwa Herz- und Augenerkrankungen oder sogar neurologische Defizite wie Demenz«, verspricht Neubauer.
An dem gerade erfolgreich abgeschlossenen Gemeinschaftsprojekt waren neben dem Fraunhofer IBMT auch das Unternehmen Janssen Pharmaceutica N.V. und das Institute for Bioengineering of Catalonia beteiligt. Das Vorhaben wurde im Rahmen der großen EU-Initiative EIT Health gefördert.