Intrinsisch ungeordnete Proteine zuverlässig vermessen
Mit einem neuen Ansatz lässt sich die Form eines ungeordneten Proteins auf zwei verschiedene Arten bestimmen – an derselben Probe
Proteine sind elementar für unsere Körperfunktionen: Tausende verschiedene Proteine übernehmen ganz unterschiedliche Aufgaben. Während einige Komponenten unserer Körperzellen bilden, kurbeln andere als Enzyme elementare Stoffwechselprozesse an, dienen als Hormone oder helfen dem Immunsystem in Form von Antikörpern bei seiner Arbeit. Vereinfacht gesagt kann man sich Proteine als lange Ketten von Aminosäuren vorstellen, die sich zu verschiedenen dreidimensionalen Strukturen organisieren. So gibt es etwa die Alpha-Helix sowie das Beta-Faltblatt. Diese Strukturen beeinflussen, wie die Proteine mit anderen Proteinen interagieren und welche Funktionen sie übernehmen. Doch sind nicht alle Proteine derart geordnet: Etwa 30 Prozent liegen in einem ungeordneten Zustand vor. Schwer zu sagen, in welchem Maße sich diese Proteine zusammenknäueln oder wie sehr sie sich in der Umgebung – also in wässriger, zellähnlicher Lösung – ausstrecken. Doch ist dies elementar für ihr Verhalten: Je kleiner die Proteine sich zusammenziehen, wenn sie alleine in wässriger Lösung schwimmen, desto leichter bilden sie Klumpen, wenn mehrere Proteine vorhanden sind.

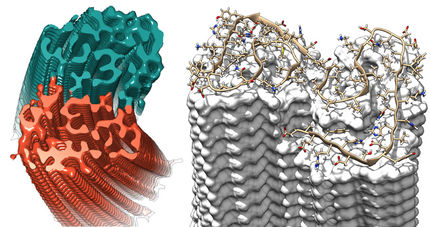
Überprüfung eines intrinsisch ungeordneten Proteins (Re ist die Höhe, Rg ist die Gesamtgröße).
© Miao Yu
Aggregation von Proteinen ist der erste Schritt zur Bildung von Plaques im Gehirn
Die intrinsisch ungeordneten Proteine können vielfach Amyloid-Formationen annehmen. Verklumpen diese Proteine im Gehirn, entstehen Ablagerungen, auch Plaques genannt, die das Risiko für die Entwicklung von Alzheimer und anderen neurodegenerativen Erkrankungen erhöhen. Biophysiker interessieren sich daher sehr für die Größe von Proteinen in Lösung. „Das Potenzial einer neurodegenerativen Krankheit liegt in diesem Ur-Parameter, schließlich lässt sich aus ihm das Aggregationspotenzial ablesen. Und die Aggregation ist ein essenzieller Schritt zur Bildung der Plaques“, sagt Prof. Dr. Edward A. Lemke vom Institut für Molekulare Physiologie der Johannes Gutenberg-Universität Mainz (JGU) und Adjunct Director am Institut für Molekulare Biologie (IMB). Die Krux: Es gibt zwei Methoden, diesen Ur-Parameter zu messen – doch kommen diese zu widersprüchlichen Ergebnissen. Über die Fluoreszenzmethode lässt sich die End-to-end-Distanz messen, also der Abstand von einem Ende der Proteinkette zum anderen. Die Röntgenkleinwinkelstreuung dagegen analysiert die Größe des Knäuels, Experten sprechen vom „Radius of Gyration“. „Zwar dienen beide Ergebnisse als Basis für Vorhersagen, dennoch ist dieser Ur-Parameter durch die Nichtvereinbarkeit der Messergebnisse Gegenstand der Diskussion“, erläutert Dr. Dmitri Svergun, ehemaliger Gruppenleiter des EMBL Hamburg.
Neuer Streuungsansatz: Radius of Gyration und End-to-end-Distance an der gleichen Probe
Dieses Dilemma konnten die Forschenden durch eine Kombination von Chemischer Biologie und Streumethoden lösen. Sie haben eine Markierungsmethode mit der Anomalen Streuung kombiniert, sodass man die Knäuelgröße ebenso messen kann wie die End-to-end-Distanz – und das an der gleichen Probe. „Auf diese Weise bekommen wir aus einer Untersuchungsmethode zwei Parameter und können analysieren, wie diese beiden Größen voneinander abhängen“, erklärt Lemke. Im Jahr 2017 konnten die Forschenden bereits beide Parameter messen, doch waren da noch zwei verschiedene Proben nötig. Nun haben sich die Parameter erstmalig auch am gleichen Sample messen lassen.
Originalveröffentlichung
Miao Yu, Andrey Yu. Gruzinov, Hao Ruan, Tom Scheidt, Aritra Chowdhury, Sabrina Giofrè, Ahmed S. A. Mohammed, Joana Caria, Paul F. Sauter, Dmitri I. Svergun, Edward A. Lemke; "A genetically encoded anomalous SAXS ruler to probe the dimensions of intrinsically disordered proteins"; Proceedings of the National Academy of Sciences, Volume 121, 2024-12-6
Gustavo Fuertes, Niccolò Banterle, Kiersten M. Ruff, Aritra Chowdhury, Davide Mercadante, Christine Koehler, Michael Kachala, Gemma Estrada Girona, Sigrid Milles, Ankur Mishra, Patrick R. Onck, Frauke Gräter, Santiago Esteban-Martín, Rohit V. Pappu, Dmitri I. Svergun, Edward A. Lemke; "Decoupling of size and shape fluctuations in heteropolymeric sequences reconciles discrepancies in SAXS vs. FRET measurements"; Proceedings of the National Academy of Sciences, Volume 114, 2017-7-17
Diese Produkte könnten Sie interessieren
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Proteinanalytik
Die Proteinanalytik ermöglicht einen tiefen Einblick in diese komplexen Makromoleküle, ihre Struktur, Funktion und Wechselwirkungen. Sie ist unerlässlich für die Entdeckung und Entwicklung von Biopharmazeutika, das Verständnis von Krankheitsmechanismen und die Identifizierung von therapeutischen Zielen. Durch Techniken wie Massenspektrometrie, Western Blot und Immunoassays können Forscher Proteine auf molekularer Ebene charakterisieren, ihre Konzentration bestimmen und mögliche Modifikationen identifizieren.

Themenwelt Proteinanalytik
Die Proteinanalytik ermöglicht einen tiefen Einblick in diese komplexen Makromoleküle, ihre Struktur, Funktion und Wechselwirkungen. Sie ist unerlässlich für die Entdeckung und Entwicklung von Biopharmazeutika, das Verständnis von Krankheitsmechanismen und die Identifizierung von therapeutischen Zielen. Durch Techniken wie Massenspektrometrie, Western Blot und Immunoassays können Forscher Proteine auf molekularer Ebene charakterisieren, ihre Konzentration bestimmen und mögliche Modifikationen identifizieren.