Wenn Hochleistungs-Zellen leuchten: Neues Verfahren zur effizienteren Herstellung rekombinanter Proteine
Eine effiziente Herstellung rekombinanter Proteine hängt insbesondere davon ab, dass es gelingt, für den Aufbau von Zellkulturen nur hochproduktive Zellen zu verwenden. Für die Identifizierung und Auswahl dieser Zellen hat ein Forscherteam am Lehrstuhl für Bioprozesstechnik der Universität Bayreuth jetzt ein kostengünstiges Verfahren entwickelt, das keinen hohen technischen Aufwand erfordert. Aus der Medizin und der Nahrungsmittelindustrie sind sie nicht mehr wegzudenken: Eiweiße, die mithilfe gentechnisch veränderter Organismen biotechnologisch hergestellt werden. In der Forschung heißen sie "rekombinante Proteine". Prominente Beispiele sind das Hormon Insulin, das die Behandlung der Zuckerkrankheit unterstützt, oder das Enzym Lab, das bei der Produktion bestimmter Käsesorten eingesetzt wird. Die künstliche Herstellung solcher Proteine folgt in allen Fällen dem gleichen Schema. Ausgangspunkt ist ein Gen, das imstande ist, in der Zelle die Entstehung des gewünschten Proteins - des sogenannten "Zielproteins" - zu steuern. Das Gen wird mithilfe eines Transportmoleküls in viele lebende Zellen eingeschleust, beispielsweise in Bakterien, Pilze oder Säugetierzellen. Jede dieser Wirtszellen baut das fremde Gen in das Genom ein, das sich im Zellkern befindet und die Gesamtheit der vererbbaren Informationen enthält. Dieser gesamte Vorgang wird in der Forschung als "Transfektion" bezeichnet. Die Herausforderung: die Identifizierung hochproduktiver Zellen Die durch Transfektion entstehenden Wirtszellen unterscheiden sich dadurch, dass sie das Gen nicht an der gleichen Stelle und auch nicht auf die gleiche Weise in das Genom einbauen. Deshalb besitzen sie - und ebenso die von ihnen abstammenden, durch Zellteilung entstehenden Zellen - eine höchst unterschiedliche Leistungsfähigkeit, was die Erzeugung des Zielproteins betrifft. Einige wenige Zellen produzieren große Mengen des Zielproteins. Viele andere Zellen hingegen erzeugen das Protein nur in kleinen Mengen oder verweigern die Herstellung sogar ganz. Eine effiziente Industrieproduktion ist deshalb nur möglich, wenn es gelingt, die hochproduktiven Zellen auszuwählen und nur sie für den Aufbau von Zellkulturen zu verwenden. Eine schwierige Aufgabe: Denn diese „Leistungsträger“ machen weit weniger als 0,5 Prozent aller Zellen aus, die bei der Transfektion entstehen. Die Forschungsidee: Verkoppelung mit dem Gen eines fluoreszierenden Proteins Zur Lösung dieser Aufgabe hat ein Forschungsteam am Lehrstuhl für Bioprozesstechnik der Universität Bayreuth jetzt ein kostengünstiges und überaus praktikables Verfahren entwickelt. Es kommt insbesondere Universitäten, Forschungsinstituten und mittelständischen Unternehmen zugute. Professorin Dr. Ruth Freitag und ihre Mitarbeiterinnen beschreiben ihre Forschungsidee und deren Umsetzung in einem Beitrag für das "Biotechnology Journal". Im Mittelpunkt des Verfahrens steht eine Variante des grün fluoreszierenden Proteins, kurz EGFP. Dieses Eiweiß hat die Eigenschaft, grün zu fluoreszieren, wenn es durch blaues oder ultraviolettes Licht angeregt wird. Für seine Entdeckung und Weiterentwicklung erhielt ein internationales Forscherteam im Jahre 2008 den Nobelpreis. Heute wird EGFP an vielen Stellen in der biologischen und chemischen Forschung eingesetzt. An diese Verwendung knüpft die in Bayreuth entwickelte gentechnische Methode an. Sie koppelt zwei Gene aneinander: das Gen, das die Erzeugung des rekombinanten Zielproteins (wie z.B. Insulin) steuert, und das Gen, das für die Erzeugung des grün fluoreszierenden Proteins zuständig ist. In dieser Verbindung werden die Gene in die Eierstockzellen eines Chinesischen Hamsters übertragen. Fortlaufende Zellteilungen bewirken, dass die miteinander verkoppelten Gene immer wieder kopiert werden. Fluoreszierende Proteine machen die hochproduktiven Zellen sichtbar Die Pointe des Verfahrens liegt in der Weise, in der das Bayreuther Forschungsteam die Gene aneinander koppelt: Die von den beiden Genen gesteuerten Prozesse der Proteinherstellung verlaufen nicht nur parallel, sondern nutzen an einer entscheidenden Station dieselbe molekulare Basis - nämlich dieselbe Messenger-RNA. Genau dadurch ist gewährleistet, dass die verkoppelten Gene in jeder neu entstehenden Zelle ungefähr gleich aktiv sind. Wo viele fluoreszierende EGFP-Moleküle entstehen, wird parallel dazu auch das Zielprotein in großem Umfang hergestellt; und wo die Zahl der produzierten EGFPMoleküle gering ist, gilt dies auch für das Zielprotein. Mit laborüblichen Geräten lassen sich nun stark und schwach fluoreszierende Zellen unterscheiden - schnell, mit hoher Präzision und ohne großen technischen Aufwand. Die stark fluoreszierenden Zellen sind genau die wenigen Zellen, die große Mengen des Zielproteins (z.B. des Insulins) produzieren und deshalb für die Einrichtung von Zellkulturen für die Produktion geeignet sind. Ein weiterer Vorteil dieser Technik: Die hochproduktiven Zellen scheiden das Zielprotein nach außen ab, während die fluoreszierenden EGFP-Moleküle im Inneren der Zelle bleiben. So ist gewährleistet, dass die in den Zellkulturen produzierten rekombinanten Proteine nicht durch EGFP-Moleküle verunreinigt werden. Originalveröffentlichung: Ruth Freitag, Valérie Jérôme, Denise Freimark; "A simple method for detection of high producing clones amongst transfected CHO cells"; Biotechnology Journal 5, 2010, pp. 24 - 31
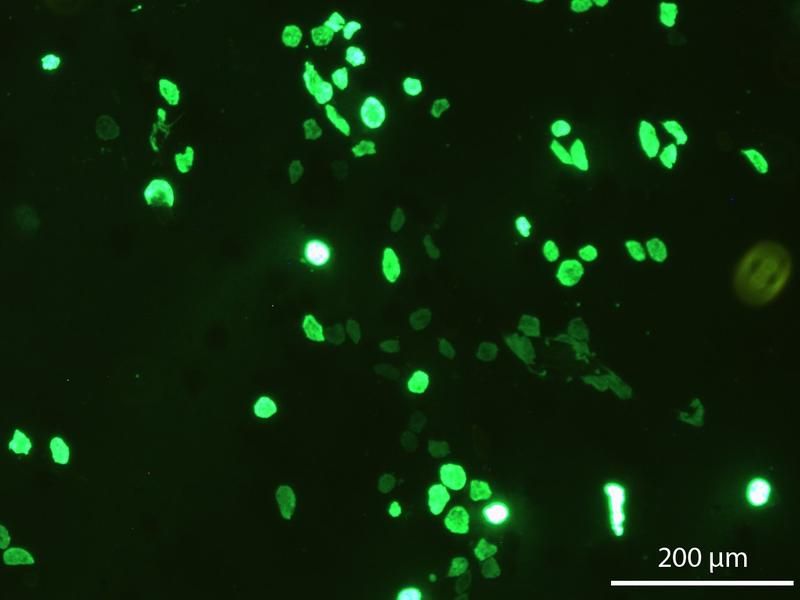
Fluoreszierende Zellen nach der Transfektion: Die starken grünen Farbpunkte markieren hochproduktive Zellen, die sowohl das grün fluoreszierende Eiweiß (EGPF) als auch das Zielprotein in besonders großem Umfang produzieren. Das Foto zeigt einen Ausschnitt aus einem Zellgemisch, der einen überdurchschnittlich großen Anteil hochproduktiver Zellen enthält.
Lehrstuhl für Bioprozesstechnik