Außen weich, innen hart
Das Transportprotein Albumin kann dank flexibler Oberflächenstruktur unterschiedliche Fracht transportieren
Albumin ist der Universaltransporter im menschlichen Blut. Das Protein befördert Fettsäuren, Hormone oder Medikamente zu ihren Zielorten im Körper. Bisherige Untersuchungen von Albumin-Kristallen zeigen lediglich Momentaufnahmen seiner räumlichen Struktur. Im Blut verändert Albumin jedoch häufig seine Gestalt. Forschern des Max-Planck-Instituts für Polymerforschung in Mainz ist es nun gelungen, dem Protein bei der Arbeit zuzusehen und seine räumliche Struktur unter natürlichen Bedingungen zu untersuchen. Dabei haben sie entdeckt, dass die zentralen Regionen des Albumins starr sind, während die Außenbereiche flexibel ihre Form ändern können.
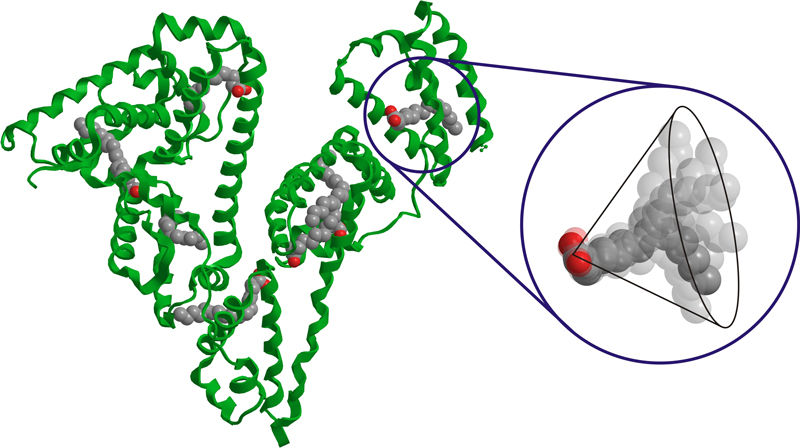
Dreidimensionale Struktur von Albumin mit eingelagerten Fettsäure-Molekülen.
MPI für Polymerforschung
Albumin-Moleküle sind mit Fettsäure-Molekülen beladen, die, wie Nägel in eine Wand, in die Proteine eindringen. Der Kopf der Fettsäuremoleküle hingegen bleibt an der Oberfläche. Röntgenstrukturuntersuchungen haben gezeigt, dass die Fettsäure-Moleküle nicht wie erwartet symmetrisch verteilt sind, sondern dass es Bereiche des Proteins gibt, in denen gehäuft Fettsäuren an das Protein binden.
Die Mainzer Forscher wollten nun herausfinden, ob die Fettsäure-Moleküle genauso verteilt sind, wenn die Proteine unter lebensähnlichen Bedingungen in Wasser gelöst sind. "Es gibt Grund zu der Annahme, dass die Funktion von Proteinen nicht allein durch ihre räumliche Struktur bestimmt wird", sagt Dariush Hinderberger, der Leiter der Mainzer Forschergruppe. Denn obwohl die Beziehung zwischen der Form eines Proteins und seiner Funktion in Lehrbüchern oft als "Schlüssel-Schloss-Prinzip" bezeichnet wird - das Protein hat speziell geformte Taschen, die nur solche Moleküle aufnehmen, die dort hineinpassen - ist die Form von Proteinen nach neueren Erkenntnissen nicht starr, sondern flexibel. "Diese Dynamik scheint für die Funktion von Proteinen wichtig zu sein. Dies trifft besonders auf Albumin zu, in dessen ‚Schloss‛ viele ‚Schlüssel‛ passen müssen, nämlich viele verschiedene Arten zu transportierender Moleküle", sagt Hinderberger.
Die Wissenschaftler haben dazu mit Fettsäuren beladene Albumin-Moleküle in Wasser gelöst, die Lösung binnen Millisekunden eingefroren und anschließend die Abstände zwischen den ans Albumin gebundenen Fettsäuren gemessen. "Bei diesem Verfahren werden Proteine in allen Phasen ihrer Dynamik, also mit unterschiedlichen Formen, eingefroren, anstatt nur in der energieärmsten Form wie bei der Kristallographie", erklärt Hinderberger. Deshalb ist gewissermaßen der gesamte Bewegungsspielraum der Proteine erfasst. Um die Abstände zwischen den Fettsäuren zu messen, nutzten die Forscher eine in Mainz mitentwickelte Methode, die Elektronen-Elektronen-Doppelresonanz (DEER).
Das Ergebnis war eine neue Überraschung: Es zeigte sich, dass die meisten Fettsäuren einen gleichmäßigen Abstand von etwa 3,6 Nanometern (millionstel Millimeter) voneinander haben. Die Zugänge zu den Kanälen, die die Fettsäuren aufnehmen, sind somit sehr viel symmetrischer und homogener auf der Proteinoberfläche verteilt als bislang vermutet. "In Lösung hat das Protein also eine symmetrischere Oberflächenstruktur als im Kristall", erklärt Hinderberger. Da Albumin in Lösung offenbar eine andere dreidimensionale Form einnimmt als im Kristall, kann es seine Form anscheinend flexibel ändern.
Anders sah das Ergebnis aus, als die Wissenschaftler die Verteilung der Fettsäure-Moleküle im Innern des Proteins untersuchten. Dabei ergab sich eine breite Verteilung der Abstände, wie man sie erwartet, wenn die Moleküle ungleichmäßig verteilt sind. "Wir folgern daraus, dass der innere Teil des Proteins recht starr, der äußere dagegen flexibel ist", interpretiert Hinderberger den Befund. Durch diese Flexibilität wird eine viel höhere Symmetrie für die Eingänge der Bindungsstellen hergestellt.
Mit ihrer Methode wollen die Mainzer Forscher nun weitere molekulare Transporter analysieren sowie die Fähigkeit von Albumin, z.B. Medikamente zu transportieren. "Mit dieser einfachen Methode können wir untersuchen, wie Proteine in ihrer natürlichen Umgebung funktionieren", sagt Hinderberger.
Originalveröffentlichung: Matthias J. N. Junk, Hans Wolfgang Spiess, Dariush Hinderberger; "Die Verteilung gebundener Fettsäuren enthüllt die funktionale Struktur von menschlichem Serum Albumin"; Angewandte Chemie