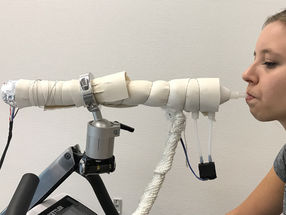
Freier Blick auf sich selbst organisierende Proteine
Auf einer künstlichen Membran konnten Biophysiker des Biotechnologischen Zentrums der Technischen Universität Dresden (BIOTEC) das erste Mal beobachten, wie sich einzelne Proteine der Min-Familie, die in Bakterien die Zellteilung regulieren, selbst und gegenseitig organisieren. Der Arbeitsgruppe von Prof. Petra Schwille, die biologische Strukturbildung an künstliche Membranen untersucht, ist ein weiterer Schritt bei der Nachbildung von Strukturen in Zellen gelungen, die nun sehr detaillierte Beobachtungen von Proteinmustern ermöglichen.
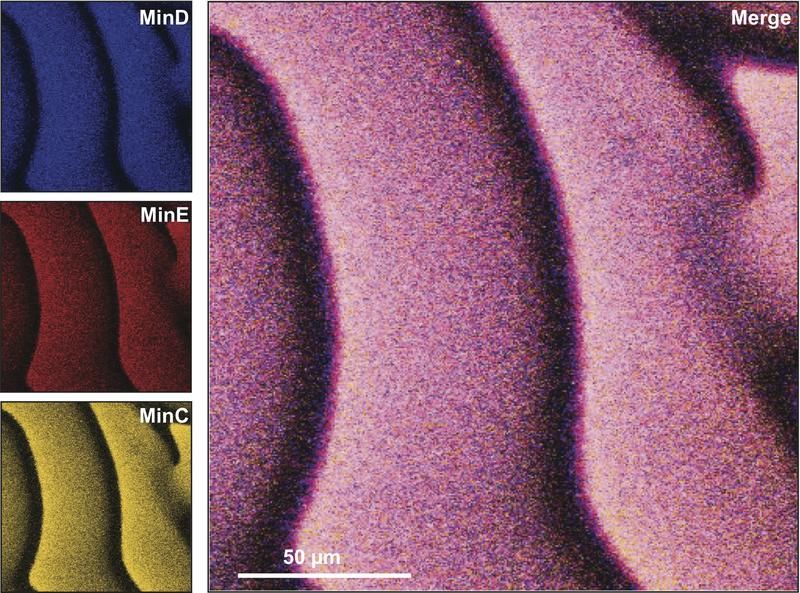
Drei verschiedene Proteine der Min-Familie bilden auf der künstlichen Membran Muster, die wie Wellen aussehen und sich von links nach rechts bewegen.
BIOTEC, Martin Loose
Jedes biologische System, so auch die Zellen, besteht zunächst aus einem Gemisch von Biomolekülen. Die Dresdner Wissenschaftler interessiert, nach welchen Gesetzen sich plötzlich und ohne Steuerung von außen die Moleküle in diesen homogenen Lösungen organisieren. In der Theorie ist das Phänomen, das sich durch Diffusion und Wechselwirkung Muster ausbilden, gut verstanden. Experimentell sind solche Prozesse allerdings schwer nachzubilden. Die Diffusion ist ein physikalischer Prozess, der zu einer gleichmäßigen Verteilung von Teilchen und somit der Durchmischung zweier oder mehrerer Stoffe führt. „Um besser zu verstehen, welche Eigenschaften die Moleküle benötigen, um verschiedene Bewegungsmuster auszubilden, haben wir ein oszillierendes System von Proteinen als Prototyp verwendet“, sagt Dr. Martin Loose von der Dresdner Arbeitsgruppe. Für seine Doktorarbeit konnte er gemeinsam mit Kollegen zum ersten Mal die Oszillation von Proteinen künstlich nachbauen. Bei seinen Versuchen hat er verschiedene Proteine der Min-Familie verwendet, die natürlicherweise in E.coli-Bakterien (Darmbakterien) vorkommen und dort die Zellteilung regulieren.
Bakterien sind von einer Zellmembran und einer formgebenden Zuckerhülle umgeben. Normalerweise befinden sich die Min-Proteine im Inneren der Bakterien, aber im zellfreien Modell des Systems werden die Proteine frei auf die Membran aufgebracht. Als hauchfeiner Film aus Lipiden liegt für die Versuche die künstliche Zellmembran auf dem Deckgläschen - ähnlich einer aufgeplatzten Seifenblase. „Das Gemisch der Min-Proteine befindet sich in Lösung über der Membran, so dass wir mit dem Fluoreszenzmikroskop genau die sich ausbreitenden Wellen beobachten können, die bei den Interaktionen der Proteine erzeugt werden“, beschreibt Loose den stark energiegetriebenen Prozess des wechselseitigen Wirkens der Proteine aufeinander.
Die Dresdner Biophysiker konnten weltweit das erste Mal beobachten, wie einzelne Moleküle der sogenannten MinD-Proteine an die künstliche Membran binden und auf welche Weise sie von den MinE-Proteinen wieder abgelöst werden. „Wir kennen zwar in etwa die Eigenschaften der einzelnen Moleküle, konnten ihr individuelles Verhalten in einer großen Ansammlung aber bisher nicht sichtbar machen.“ Martin Loose ist sich sicher: „Unser mechanistischer Prototyp bringt uns weiter, biologische Selbstorganisation besser zu verstehen.“
Originalveröffentlichung
Diese Produkte könnten Sie interessieren
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Fluoreszenzmikroskopie
Die Fluoreszenzmikroskopie hat die Life Sciences, Biotechnologie und Pharmazie revolutioniert. Mit ihrer Fähigkeit, spezifische Moleküle und Strukturen in Zellen und Geweben durch fluoreszierende Marker sichtbar zu machen, bietet sie einzigartige Einblicke auf molekularer und zellulärer Ebene. Durch ihre hohe Sensitivität und Auflösung erleichtert die Fluoreszenzmikroskopie das Verständnis komplexer biologischer Prozesse und treibt Innovationen in Therapie und Diagnostik voran.
Themenwelt Fluoreszenzmikroskopie
Die Fluoreszenzmikroskopie hat die Life Sciences, Biotechnologie und Pharmazie revolutioniert. Mit ihrer Fähigkeit, spezifische Moleküle und Strukturen in Zellen und Geweben durch fluoreszierende Marker sichtbar zu machen, bietet sie einzigartige Einblicke auf molekularer und zellulärer Ebene. Durch ihre hohe Sensitivität und Auflösung erleichtert die Fluoreszenzmikroskopie das Verständnis komplexer biologischer Prozesse und treibt Innovationen in Therapie und Diagnostik voran.