Immer der Reihe nach: Molekülkontrolle am Nano-Sensor
In der Natur gibt es viele Vorbilder für hochsensitive Sensoren. Ein Beispiel dafür sind die Geruchsrezeptoren der menschlichen Nase, die ganz speziell auf einzelne Moleküle ansprechen. Davon inspiriert, hat ein Forscherteam der Technischen Universität München und der Goethe Universität Frankfurt jetzt ein System aus festkörperbasierten Nanoporen entwickelt, mit dem sich einzelne Moleküle identifizieren lassen. Gegenüber früheren Arbeiten auf diesem Gebiet haben die Wissenschaftler erreicht, dass der Sensor zwei Eigenschaften vereint: er reagiert auf einzelne Moleküle und erkennt gleichzeitig ihre Identität.
Die Entwicklung hochauflösender Nachweismethoden auf molekularer Ebene schreitet immer weiter voran. Inzwischen gibt es viel versprechende Ansätze für neue Nanowerkzeuge, mit denen sich selbst einzelne Moleküle identifizieren lassen. Eines dieser Verfahren arbeitet nach dem Prinzip einer Nanoschleuse, die Moleküle nur einzeln passieren lässt. Dem Wissenschaftler-Team aus München und Frankfurt ist es jetzt gelungen, einen solchen Nano-Sensor zusätzlich mit biologischen Funktionen auszustatten, so dass auch die Identität der durchgeschleusten Moleküle ermittelt werden kann.
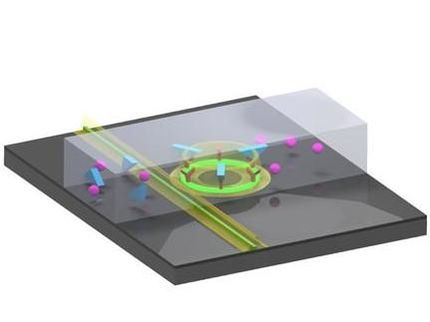
Das Prinzip des Sensors: Mit Hilfe eines Elektronenstrahls bohren die Wissenschaftler winzige Löcher mit einem Durchmesser von 25 Nanometer in eine dünne Halbleitermembran aus Siliziumnitrid. Diese Öffnung ist gerade groß genug für ein einzelnes Molekül. Um sicherzugehen, dass Biomoleküle nicht zufällig an Unebenheiten der Pore binden, wird diese mit einer selbstorganisierenden Schicht ausgekleidet, an der Proteine nicht haften bleiben. In dieser Schicht ist der Rezeptor aus mehreren Nitrilotriessigsäure-Molekülen verankert. Dieser Rezeptor erkennt und bindet spezifische Moleküle, die vorab mit einem „Etikett“ aus sechs Aminosäuren (Histidin) ausgezeichnet wurden. Nach dem gleichen Prinzip können aber auch ganze Proteine in der Pore eingesetzt werden, die wiederum als Torwächter andere Proteine beim Durchtritt „kontrollieren“ und gegebenenfalls für eine bestimmte Zeit binden. Die anorganische Pore übernimmt damit die biologische Funktion des verankerten Proteins. Auf diese Weise konnten die Forscher auch Subklassen von IgG-Antikörpern aus Ratten und Hamstern unterscheiden.
Die Messungen an der Nanoschleuse laufen in einer Salzlösung ab. Legt man elektrische Spannung an, strömen die Ionen der Lösung durch die Poren. Sobald sich das passende Biomolekül an den Rezeptor bindet, verengt sich die Pore und der Stromfluss nimmt ab. Auf diese Weise kann das An- und Abbinden eines bestimmten Moleküls in Echtzeit beobachtet werden. Voraussetzung dafür ist allerdings, dass sich nur ein einziger Rezeptor in der Pore befindet – was den Wissenschaftlern mit diesem Verfahren zum ersten Mal gelang.
Die möglichen Anwendungsgebiete dieses biomimetischen sensorischen Systems sind vielversprechend. So könnten schwierige Probleme in der Proteomik mit diesem Ansatz realisierbar sein, etwa die Analyse der Proteinzusammensetzung einer einzelnen Zelle. Zum anderen könnte dieses System als schneller und sensitiver Biosensor für das Screening von Pharmazeutika oder zur Detektion von Biowaffen dienen.
„Bisher richtet sich die Nanoporenforschung vor allem auf DNA-Detektion und Sequenzierung. Unsere Ergebnisse zeigen, dass Nanoporen das Potenzial haben, sich zu einem wichtiges Werkzeug in der Proteinforschung zu entwickeln“, erklärt Dr. Ulrich Rant vom Walter-Schottky-Institut und Institute for Advanced Study an der TU München. „Und wer weiß, vielleicht finden Nanoporen-Proteinsensoren schon bald Anwendung in der medizinischen Diagnostik. Vorstellbar wäre zum Beispiel, bei Patienten molekulare Krankheitsmarker nachzuweisen, die in nur sehr geringen Konzentrationen vorkommen.“
„Die Zukunft bleibt spannend, da die Natur uns weiterhin in Selektivität und Spezifität voraus ist. Deshalb sind weitere Verbesserungen im Feld von sensorischen Systemen auf molekularer Ebene nötig“, ergänzt Prof. Robert Tampé vom Institut für Biochemie an der Goethe Universität Frankfurt. „Die Zusammenarbeit des Teams aus München und Frankfurt ist aber ein wichtiger Schritt in der Biosensorik und Nanodiagnostik auf Einzelmolekülebene.“
Die Arbeiten wurden gefördert aus Mitteln der Deutschen Forschungsgemeinschaft SFB 863 und SFB 807), TUM Institute for Advanced Study, Exzellenzcluster Nanosystems Initiative Munich, und Exzellenzcluster Macromolecular Complexes (Goethe-Universität Frankfurt).