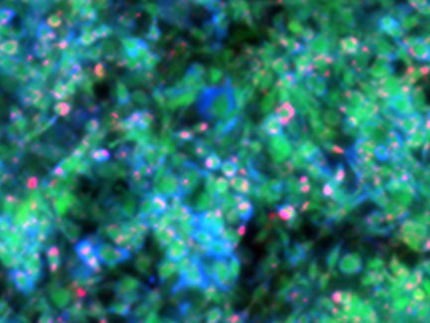
Molekülbewegungen in lebenden Zellen sehen
Schnelle Bewegungen von Molekülen in lebenden Proben zu erfassen, ermöglicht die neu entwickelte STED-RICS-Mikroskopie. Forscher am Karlsruher Institut für Technologie haben die Raster-Bild-Korrelationsspektroskopie (RICS) mit der STED-Fluoreszenzmikroskopie kombiniert. Die Methode eröffnet neue Möglichkeiten in der medizinischen Forschung, etwa bei der Untersuchung der Dynamik von Zellmembranen auch bei hohen Proteinkonzentrationen.
Beim STED-RICS-Mikroskop wird die fluoreszierende Zellmembran mit einem Licht-punkt abgerastert und dadurch ein Bild aufgenommen.
P.N. Hedde/KIT
Wie bewegen sich einzelne Biomoleküle in lebenden Zellen, Geweben oder ganzen Organismen? Wie wirken die Biomoleküle zusammen? Die Fragen sind wesentlich, um Lebensprozesse auf molekularer Ebene besser zu verstehen. Die STED-Fluoreszenzmikroskopie ermöglicht es, Bewegungen und Wechselwirkungen von Biomolekülen in lebenden Proben räumlich und zeitlich aufgelöst zu verfolgen. Dazu werden die zu untersuchenden Strukturen mithilfe von Fluoreszenzfarbstoffen selektiv markiert; die zeitlichen Veränderungen lassen sich anschließend in Videos beobachten. Allerdings ist die Bildfolge recht langsam, sodass sich schnelle Molekülbewegungen nicht direkt erfassen lassen. Eine Gruppe von Forschern des Karlsruher Instituts für Technologie (KIT) um Professor Gerd Ulrich Nienhaus vom Institut für Angewandte Physik (APH) und vom Center for Functional Nanostructures (CFN) stellt nun eine neue Methode vor, um solche schnellen Molekülbewegungen in lebenden Proben zu messen.
Die neue Methode kombiniert zwei Verfahren der Mikroskopie: Mit einem konfokalen Rastermikroskop werden Fluoreszenzbilder Punkt für Punkt in festen Zeitabständen aufeinanderfolgend aufgenommen; die Bilder enthalten also eine implizite Zeitstruktur. Diese Information lässt sich mithilfe der Raster-Bild-Korrelationsspektroskopie (raster image correlation spectroscopy, RICS) nutzen, um die Dynamik von Biomolekülen, beispielsweise Proteinen, in lebenden Zell- oder Gewebeproben zu bestimmen. Allerdings sind die Proteinkonzentrationen häufig zu hoch, um RICS mit konventioneller Mikroskopie anzuwenden. Die KIT-Forscher haben daher die RICS-Methode mit der STED-Mikroskopie (stimulated emission depletion microscopy) kombiniert. STED ermöglicht es, den zum Abrastern des Fluoreszenzbilds verwendeten Lichtpunkt erheblich zu verkleinern. Bei der Bildgebung an Zellen wurde dieses Verfahren bereits erfolgreich eingesetzt, um die höchstmögliche Auflösung zu erzielen. Bei einem STED-Mikroskop handelt es sich um ein Fluoreszenzmikroskop, dessen Auflösung nicht durch das Abbe-Limit begrenzt ist.
Durch die Kombination der Raster-Bild-Korrelationsspektroskopie mit der STED-Mikroskopie haben die KIT-Forscher es nun ermöglicht, die Moleküldynamik innerhalb von biologischen Strukturen aus den gewonnenen Rasterbildern zu quantifizieren. „Das heißt, mit der STED-RICS-Methode lässt sich aus jedem Fluoreszenzbild eine hochaufgelöste Karte der Anzahl und Beweglichkeit der fluoreszenzmarkierten Moleküle innerhalb des vom Abtastpunkt erfassten Raumgebiets erstellen“, erklärt Gerd Ulrich Nienhaus.
In der Arbeitsgruppe von Professor Nienhaus arbeiten Physiker, Chemiker und Biologen zusammen. Diese interdisziplinäre Kompetenz ist erforderlich, um die verschiedenen Aspekte bei der Entwicklung neuer mikroskopischer Instrumente und Methoden für Untersuchungen in der biophysikalischen Grundlagenforschung abzudecken. Wenn es um die Anwendung geht, arbeitet die Gruppe häufig mit weiteren Forschern am KIT zusammen, die ihr Wissen über molekulare Prozesse einbringen – im Fall der STED-RICS-Methode mit Wissenschaftlern des Instituts für Toxikologie und Genetik (ITG) sowie der Abteilung für Zell- und Entwicklungsbiologie des Zoologischen Instituts.
Die STED-RICS-Methode eröffnet neue Messmöglichkeiten in den Lebenswissenschaften. Ein wichtiges Anwendungsfeld ist die Erforschung der Dynamik von Zellmembranen. In die Membranen ist eine Vielzahl von Rezeptorproteinen eingebettet, die durch Wechselwirkung mit von außen andockenden Ligandenmolekülen externe Signale ins Zellinnere weiterleiten. Mit STED-RICS können Forscher nun Bewegungen sowohl der Lipide als auch der Rezeptoren präzise und quantitativ bestimmen. Das Verständnis dieser Prozesse ist für die medizinische und pharmazeutische Forschung äußerst wichtig: Viele pharmazeutische Wirkstoffe basieren auf der Beeinflussung dieser Wechselwirkungen. „Etwa jedes zweite Medikament beeinflusst beispielsweise die Signaltransduktion von G-Protein-gekoppelten Rezeptoren, einer wichtigen Subklasse“, erklärt Professor Nienhaus.
Originalveröffentlichung
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Fluoreszenzmikroskopie
Die Fluoreszenzmikroskopie hat die Life Sciences, Biotechnologie und Pharmazie revolutioniert. Mit ihrer Fähigkeit, spezifische Moleküle und Strukturen in Zellen und Geweben durch fluoreszierende Marker sichtbar zu machen, bietet sie einzigartige Einblicke auf molekularer und zellulärer Ebene. Durch ihre hohe Sensitivität und Auflösung erleichtert die Fluoreszenzmikroskopie das Verständnis komplexer biologischer Prozesse und treibt Innovationen in Therapie und Diagnostik voran.
Themenwelt Fluoreszenzmikroskopie
Die Fluoreszenzmikroskopie hat die Life Sciences, Biotechnologie und Pharmazie revolutioniert. Mit ihrer Fähigkeit, spezifische Moleküle und Strukturen in Zellen und Geweben durch fluoreszierende Marker sichtbar zu machen, bietet sie einzigartige Einblicke auf molekularer und zellulärer Ebene. Durch ihre hohe Sensitivität und Auflösung erleichtert die Fluoreszenzmikroskopie das Verständnis komplexer biologischer Prozesse und treibt Innovationen in Therapie und Diagnostik voran.