Schnappschuss aus der Zentrale des pflanzlichen Immunsystems
Die molekulare Architektur von drei Schlüsselproteinen und ihren Komplexen zeigt, wie Pflanzen die Abwehr von Krankheitserregern dirigieren
Pflanzen werden in ihrer natürlichen Umgebung nur selten krank. Droht eine Infektion, wird schnell über die nötigen Gegenmaßnahmen entschieden. Die Weichen stellt ein Protein, das zu diesem Zweck Komplexe mit seinen Partnerproteinen bildet. Jane Parker vom Max-Planck-Institut für Pflanzenzüchtungsforschung in Köln und Karsten Niefind vom Institut für Biochemie der Universität Köln haben mit ihren Mitarbeitern die dreidimensionale Struktur eines solchen Komplexes ermittelt. Mit diesen Nahaufnahmen wird man die pflanzliche Immunabwehr bald besser verstehen können.
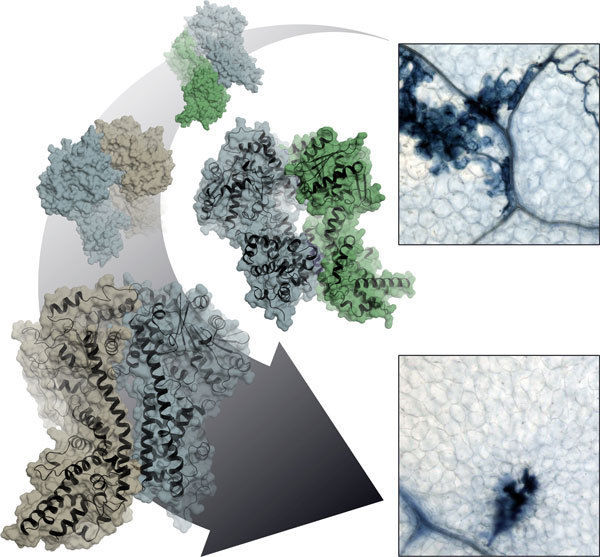
Planzenzellen im Kampf gegen mikrobielle Krankheitserreger: Heterodimere Proteinkomplexe aus EDS1 (blau) sowie SAG101 (grün) oder PAD4 (braun) steuern, welche Zellen am Infektionsherd geopfert werden und welche gegen eine Ausbreitung des Pathogens immunisiert werden.
© MPI f. Pflanzenzüchtungsforschung/Stephan Wagner
Pflanzen setzen sich - wie andere Lebewesen auch - gegen Krankheitserreger zur Wehr. Weil diese Immunreaktionen aber mit erheblichem Stress verbunden sind, entscheiden die infizierten Zellen sehr genau, was tatsächlich nötig ist. Dafür verwenden sie mehrere Verteidigungslinien. Jede vom Krankheitserreger eroberte Verteidigungslinie zwingt die infizierten Zellen zu größeren Anstrengungen bei der Immunabwehr. Am Infektionsort setzen sie auf eine radikale Lösung und schicken die infizierte Zelle in den programmierten Zelltod, den sie allerdings genau kontrollieren müssen. Über eine Änderung des genetischen Programms wird der Rest der Pflanze gewarnt, so dass er sich auf einen möglichen Angriff vorbereiten kann.
Eine Verteidigungslinie ist die sogenannte „Effektor getriggerte Immunität“. Bei dieser Stufe erkennen pflanzliche Immunrezeptoren die spezifischen Virulenzfaktoren eines hochangepassten Krankheitserregers. Was danach geschieht, hängt davon ab, welche Komplexe das mobile, im Zellkern und im Zytoplasma vorhandene Protein EDS1 mit seinen Partnerproteinen PAD4 und SAG101 bildet. EDS1 stellt die Weichen bei der Organisation der Immunabwehr, indem es sich mit seinen Partnern zu verschiedenen Zweierkomplexen - sogenannten Heterodimeren - zusammenfindet. Je nach Art des Komplexes variiert die Immunantwort. Strukturell gesehen sind die drei Eiweiße ähnlich. Die Vielfalt entsteht durch die Komplexbildung, die genau abgestimmte Reaktionen möglich macht. „Wir wollen wissen, wie die Dynamik bei der Übermittelung der Resistenzsignale funktioniert, wie über bestimmte Resistenzleistungen entschieden wird und wie die verschiedenen Stoffwechselwege zur Stressbewältigung miteinander kommunizieren“, sagt Jane Parker über ihr Interesse an den drei Proteinen.
Karsten Niefind und Stephan Wagner von der Universität Köln haben zusammen mit Jane Parker und Johannes Stuttmann vom Max-Planck-Institut für Pflanzenzüchtungsforschung sowie weiteren Kollegen die atomare Struktur des EDS1-SAG101 Komplexes durch Röntgenstrukturanalyse ermittelt und aus dieser dreidimensionalen Struktur ein Modell für den EDS1-PAD4 Komplex abgeleitet. Alle drei Eiweiße besitzen an ihrem N-terminalen Ende eine Domäne mit einer sogenannten α/β-Hydrolasefaltung. Diese Faltung ist eine der erfolgreichsten Architekturen in der Proteinevolution. Sie kommt in ähnlicher Form auch in fettspaltenden Lipasen und diversen anderen Enzymen vor. „Wir wollten natürlich wissen, ob EDS1 alleine oder im heterodimeren Komplex eine Lipase-Aktivität hat und ob EDS1 diese Lipase-Aktivität für seine Funktionen braucht“, sagt Parker. „Die überraschende Antwort der Struktur lautet nein, denn das potenzielle aktive Zentrum wird vollständig durch eine Art Deckel abgeschirmt. Auch im Reagenzglas konnten wir keinerlei Lipase-Aktivität entdecken.“ Mehr noch: Parker und ihre Kollegen haben gezeigt, dass Arabidopsis-Pflanzen, in denen das vermeintliche katalytische Zentrum von EDS1 und PAD4 durch Mutationen zerstört worden ist, trotzdem genauso resistent gegenüber bestimmten Krankheitserregern sind wie der Wildtyp.
Wie meistert nun EDS1 seine Aufgabe, wenn nicht über die katalytische Aktivität? Hier gibt die Röntgenstruktur des EDS1/SAG101-Komplexes einen wertvollen Fingerzeig. EDS1 besitzt in seiner N-terminalen Domäne eine auffällige Ausstülpung, die sich wie ein Anker in eine passende Mulde von SAG101 legt. Auch PAD4 ist mit dieser Mulde ausgestattet und kann die entsprechende Ausstülpung von EDS1 beherbergen. Die Kölner Wissenschaftler haben diese Regionen nun gezielt mutiert und dadurch gezeigt, dass die zentrale Aufgabe der Lipase-ähnlichen Domäne in der Bereitstellung dieser Kontaktflächen besteht. Erst durch das Zusammengehen von Mulde und Ausstülpung werden die wichtigen C-terminalen Domänen der beiden Komplexpartner in räumliche Nähe gebracht, so dass ein neues funktionelles Modul entstehen kann. Ohne Lipase-ähnliche Domäne also keine stabilen Komplexe, ohne heterodimerisierte C-terminale Domäne keine Immunantwort!
Wie es nach der Bildung der Heterodimere in der Zelle weitergeht, wird derzeit intensiv untersucht. Niefind dazu: „Die Röntgenstruktur hat uns nicht nur den Mechanismus der Heterodimerisierung in der EDS1-Proteinfamilie offenbart. Sie zeigt uns auch markante Oberflächen und Bindungstaschen, die nur in den Dimeren existieren und die der Schlüssel für ein umfassendes Verständnis pflanzlicher Pathogenabwehr sein werden.“