Der Schatten einer Krankheit: Biosensor für einzelne Moleküle
Proteine wie etwa Tumormarker lassen sich anhand ihres Streulicht einfach und mit hoher Empfindlichkeit nachweisen
Manche Krankheiten könnten sich künftig früher diagnostizieren und so auch besser therapieren lassen. Forscher des Max-Planck-Instituts für die Physik des Lichts in Erlangen haben einen optischen Biodetektor entwickelt, der einzelne Proteine wie etwa charakteristische Eiweiße für manche Krebsart sichtbar macht. Das können zwar auch andere Verfahren, aber nur wenn die gesuchten Biomoleküle vorher mit fluoreszierenden Anhängseln versehen werden. Bei manchen Proteinen ist das aber schwierig oder gar nicht möglich. Die Erlanger Forscher detektieren mit ihrer Methode namens iSCAT dagegen direkt das Streubild einzelner Proteine, sie machen also deren Schatten sichtbar. Der Biosensor könnte nicht nur medizinische Diagnosen empfindlicher machen, sondern auch neue Einsichten in biologische Prozesse liefern.
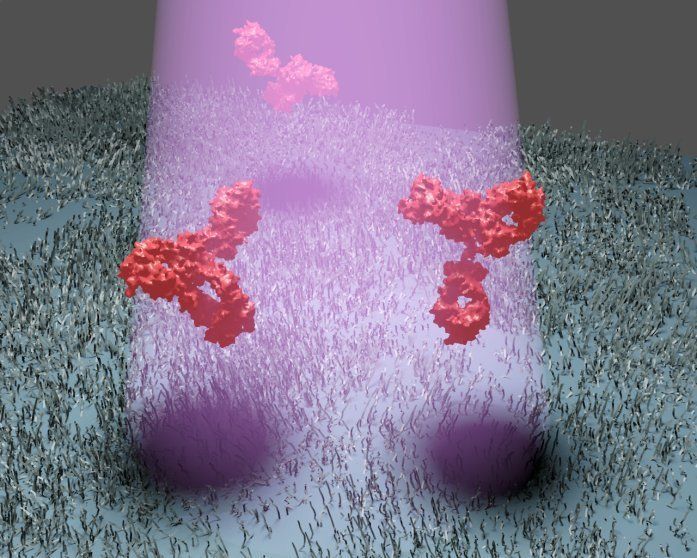
Einzelne unmarkierte Proteine können Erlanger Forscher anhand des schwachen Schattens identifizieren, den die Biomoleküle erzeugen, wenn sie Licht streuen. Für ihren Biosensor nutzen die Wissenschaftler eine ausgesprochen empfindliche Methode, um Streulicht zu detektieren. Zudem haben sie einen Weg gefunden das störende optische Rauschen des Hintergrundes gewissermaßen auszublenden.
© Max Planck Institute for the Science of Light
Ein einzelnes Protein in einer Zelle aufzuspüren, ist ungefähr so einfach, wie im Berufsverkehr auf Deutschlands Autobahnen ein bestimmtes Auto zu finden – wenn es keine Nummernschilder gäbe. Denn Myriaden unterschiedlicher Proteine wuseln dort durcheinander. Zwar können Biologen eine Sorte von Eiweißmolekülen mit chemischen Angeln aus dieser unübersichtlichen Suppe herausfischen und auf einem Mikroskopträger fixieren. Das hilft ihnen aber kaum: Wenn sie in einem Lichtmikroskop die Beute ihres Fischzugs durchleuchten, heben sich die gesuchten Proteine nicht vom Hintergrund ab.
Vahid Sandoghdar, Direktor am Max-Planck-Institut für die Physik des Lichts, und Marek Piliarik, Postdoc in Sandoghdars Abteilung, erzeugen nun ein viel übersichtlicheres Bild, ohne die Zielproteine aufwendig mit leuchtenden Markern zu versehen. Möglich wird das dank iSCAT, kurz für interferometric detection of scattering oder interferometrische Detektion von Streulicht. Dabei durchleuchten die Forscher einen Mikroskopträger, auf dem die gesuchten Proteine mit passenden biochemischen Ködern gefangen und festgesetzt werden, mit Laserlicht. Die Proteine streuen das Licht, werfen also einen Schatten, wenn auch einen sehr schwachen. „iSCAT öffnet eine Türe nicht nur für eine empfindlichere Diagnostik von Krankheiten wie Krebs, sondern auch für die Untersuchung vieler fundamentaler biochemischer Prozesse in der Natur“, sagt Vahid Sandoghdar.
Das Streubild eines Proteins wird verstärkt und vom Rauschen befreit
Die Erlanger Forscher machen ihren Biosensor empfindlich für einzelne unmarkierte Proteine, indem sie einige Tricks anwenden – und weil sie sich von den Vorbehalten vieler Wissenschaftler nicht haben beirren lassen: „Bisher galt die Meinung, dass man Hintergrundlicht eliminieren soll, wenn man das Streulicht von Nanopartikeln detektieren möchte“, erklärt Vahid Sandoghdar. „Wir haben dagegen in den vergangenen Jahren realisiert, dass es vorteilhafter ist, die Probe stark zu beleuchten und das winzige Signal als Schatten im intensiven Hintergrundlicht sichtbar zu machen.“ Daher lassen die Forscher das Hintergrundlicht mit dem schwachen Streulicht interferieren, sodass das gesuchte Signal verstärkt wird.
Auf dem Interferenzbild können die Forscher die Proteinschatten allerdings noch nicht ausfindig machen, weil dieses Bild an das Standbild einer völlig verrauschten Fernsehübertragung in schwarz-weiß erinnert: Die interferometrische Detektion ist so empfindlich, dass auch jede winzige Rauigkeit oder Verunreinigung auf dem Probenträger einen Schatten erzeugt, der sogar deutlich stärker sein kann als der eines Proteins.
Das ficht die beiden Erlanger Forscher aber nicht an. Denn mit einem zweiten Kniff beseitigen sie das Rauschen. Sie schießen mit dem iSCAT-Mikroskop nicht nur eine Aufnahme, nachdem sie eine Lösung mit dem gesuchten Protein auf den Träger geträufelt haben, sondern auch davor. „Da der größte Teil des optischen Rauschens durch nanoskopische Unebenheiten des Probenträgers entsteht, die sich nicht verändern, können wir die beiden Bilder voneinander abziehen und so das Rauschen eliminieren“, erklärt Piliarik. Die gesuchten Proteine heben sich dann als dunkle Punkte klar vom Hintergrund ab, obwohl der Schatten des Proteins nur um ein Zehntausendstel oder gar ein Hunderttausendstel dunkler ist als der Hintergrund.
iSCAT identifiziert ein gesuchtes Protein unter 2000 anderen
Als Schatten im Mikroskop wiesen Marek Piliarik und Vahid Sandoghdar verschiedene unmarkierte Proteine nicht nur in entsprechenden reinen Lösungen nach. Sie spürten einzelne Eiweiße auch in Mischungen auf, die bis zu 2000mal mehr an anderen Proteinen enthielten. „Dabei limitiert uns jedoch nicht die Empfindlichkeit der Optik, wie spezifisch wir ein gesuchtes Protein identifizieren können, sondern die Selektivität der Substanzen, mit denen die Zielproteine auf dem Mikroskopträger gebunden werden“, sagt Marek Piliarik. Wie die Forscher zudem feststellten, hängt die Stärke des Kontrasts zwischen Eiweiß und Hintergrund von der Größe des gesuchten Teilchens ab. Sie fanden sogar Hinweise, dass dieser Kontrast auch etwas über die Form des Proteins verraten kann.
„Die Stärke unseres Biosensors liegt nicht nur darin, dass sie so empfindlich ist und wir damit gesuchte Proteine in einer Probe zählen können“, sagt Vahid Sandoghdar. „iSCAT zeigt uns auch die genaue Position der Teilchen.“ Das könnten Biologen ausnutzen, um zu studieren, ob und wie verschiedene Proteine aneinander binden. Das Zusammenspiel der Proteine zu kennen, ist für das Verständnis von Krankheiten und einer Vielzahl biologischer Vorgänge wichtig. Und möglicherweise können Biologen mit iSCAT künftig auch noch kleinere Teilchen als Proteine, also etwa RNA-Schnipsel, beobachten und verfolgen, wie sie sich gegenüber anderen Substanzen verhalten. Zu diesem Zweck wollen die Erlanger Forscher das Verhältnis von Signal zu Rauschen in ihrem Biodetektor noch verbessern. Dass dies prinzipiell möglich ist, wissen die Erlanger Forscher bereits. Und sie haben auch schon Ideen, wie.