Röntgenlaser enthüllt Struktur von Blutdruckregler
Vielversprechender Schritt zu neuen und besseren Medikamenten
Mit einer ausgeklügelten Röntgenuntersuchung hat ein amerikanisch-deutsches Forscherteam unter Beteiligung von DESY die molekulare Struktur eines wichtigen Blutdruck-Regulators im menschlichen Körper aufgeklärt. Die Studie, die im Fachblatt „Cell“ erscheint, gibt neue Einblicke in die genaue Funktionsweise des Rezeptors und könnte der Entwicklung neuer und nebenwirkungsärmerer Blutdrucksenker dienen, wie die Wissenschaftler unter Leitung von Prof. Vadim Cherezov von der University of Southern California erläutern. Bluthochdruck ist das häufigste Herz-Kreislauf-Leiden in den Industrieländern.
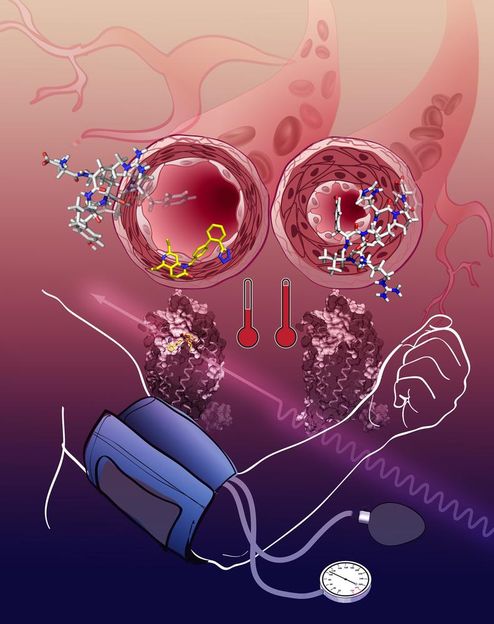
Die Aktivierung des Angiotensinrezeptors führt zu einer Verengung der Bultgefäße, der Blutdruck steigt (rechts). Die AT1R-Blockade entspannt die Gefäße, der Blutdruck sinkt (links).
Katya Kadyshevskaya, Bridge Institute, USC
Die Forscher hatten mit dem stärksten Röntgenlaser der Welt, der Linac Coherent Light Source LCLS am US-Forschungszentrum SLAC, den sogenannten Angiotensin-Rezeptor AT1R untersucht. Werden diese Rezeptoren durch das Hormon Angiotensin aktiviert, führt das zu einer Verengung der Blutgefäße – der Blutdruck steigt. „Medikamente namens Angiotensin-Rezeptor-Blocker, kurz ARB, sind eine der weit verbreiteten Strategien gegen Bluthochdruck“, erklärt Cherezov.
Wie diese Mittel auf molekularer Ebene funktionieren, war bis dato allerdings nicht genau geklärt, betont DESY-Forscher Cornelius Gati vom Hamburger Center for Free-Electron Laser Science CFEL, der die Daten der Röntgenuntersuchung ausgewertet hat. „Trotz der großen medizinischen Bedeutung war die Struktur des Rezeptors bislang unbekannt.“ Das CFEL ist eine Kooperation von DESY, Max-Planck-Gesellschaft und Universität Hamburg.
Für die Strukturuntersuchung mit Röntgenlicht müssen die Forscher zunächst Kristalle aus den gewünschten Biomolekülen züchten. Aus der charakteristischen Weise, wie diese Kristalle das Röntgenlicht streuen, lässt sich dann die räumliche Struktur dieser Moleküle berechnen. Die Zucht der Kristalle ist jedoch vor allem im Fall von Biomolekülen oft schwierig. Viele dieser Proteine lassen sich nur mit Tricks in Kristallform zwingen, da sie nicht ihrem natürlichen Zustand entspricht. „Die AT1R-Kristalle, die wir erzielen konnten, waren nadelförmig und zu klein für die klassische Kristallographie“, berichtet Cherezov.
Erst mit den intensiven Blitzen des ultrahellen Röntgenlasers ließen sich den Kristallen die Strukturinformationen entlocken. Die Forscher sprühten in den Röntgenstrahl AT1R-Kristalle, an denen bereits ein blockierendes Molekül gebunden war. Dieses Molekül namens ZD7155 ist ein chemischer Vorläufer einer der am meisten verwendeten ARB aus der wichtigen Gruppe der Sartane.
Auf diese Weise konnten die Wissenschaftler die genaue Struktur des blockierten Rezeptors untersuchen. Die Ergebnisse enthüllen den molekularen Aufbau des Rezeptors mit einer Genauigkeit von 0,29 Nanometern (milionstel Millimetern), das liegt in der Größenordnung von Atomen. „Die Daten zeigen die genaue Struktur der sogenannten Bindungstasche und die Interaktion mit Blutdrucksenkern, die dort ankoppeln“, erläutert Gati. „Das liefert neue Einblicke in den Wirkmechanismus und ermöglicht die Entwicklung neuer Wirkstoffe.“
Der Angiotensin-Rezeptor gehört zur medizinisch wichtigen und großen Klasse der G-Protein-gekoppelten Rezeptoren (GPCR). Diese Rezeptoren sitzen in der Zellmembran und lösen durch ein äußeres Signal (in diesem Fall das Ankoppeln von Angiotensin) eine Wirkung im Inneren der Zelle aus. Solche Transmembran-Rezeptoren sind für die Pharmaindustrie besonders interessant, weil sich über sie eine Wirkung in der Zelle auslösen lässt, ohne dass ein Medikament bis in die Zelle hinein gelangen muss.
Der Angiotensin-Rezeptor AT1R vermittelt seine Signale aber nicht nur über das weit verbreitete G-Protein, sondern auch über den sogenannten Arrestin-Signalweg. „Den G-Protein-Signalweg zu blockieren, ist günstig, während die Blockade des Arrestin-Signalwegs nachteilig ist und zu vielen Nebenwirkungen führt“, berichtet Cherezov. „Alle Angiotensin-Rezeptor-Blocker, die gegenwärtig auf dem Markt sind, blockieren beide Signalwege.“
Die Forscher hoffen nun, dass die detaillierte Kenntnis der Rezeptor-Struktur zur Entwicklung von Blutdrucksenkern mit weniger Nebenwirkungen beitragen kann. „Unsere Arbeit stellt einen ersten Schritt in diese Richtung dar“, sagt Cherezov. „Als nächstes planen wir unter anderem, diesen Rezeptor in einem Komplex mit einem Aktivator zu untersuchen, sowie die Struktur des eng verwandten Rezeptors AT2R aufzuklären.“
Originalveröffentlichung
Structure of the Angiotensin Receptor Revealed by Serial Femtosecond Crystallography; Haitao Zhang et al.; „Cell”, 2015