Membranprotein erstmals entschlüsselt
Dreidimensionale (3D) Atommodelle von Proteinen sind wichtig, um deren Funktion zu verstehen. Dies ermöglicht unter anderem die Entwicklung neuer Therapieansätze für Krankheiten. Berner Strukturbiologen ist es nun gelungen, die Struktur eines wichtigen Membranproteins zu entschlüsseln – dies gelingt relativ selten und ist eine Premiere in Bern.
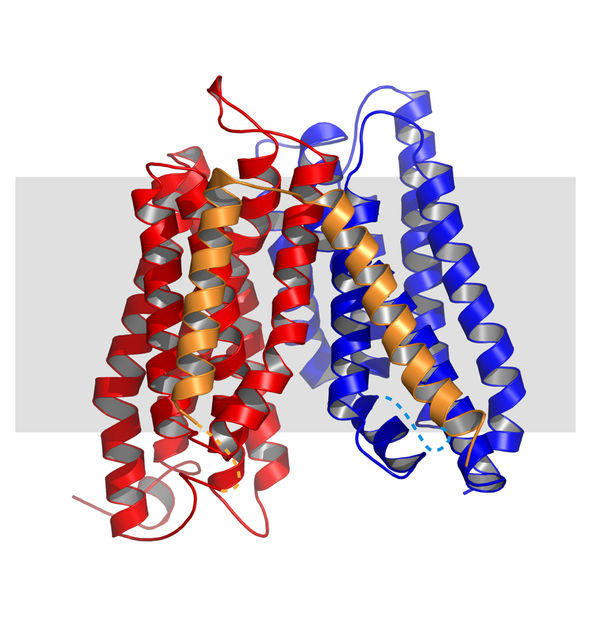
3D-Modell des Peptidtransporters «YePEPT» aus dem Bakterium Yersinia enterocolitica mit 14 Domänen, die durch die Zellmembran gehen: Zwei ähnliche «Bündel» (rot/blau) mit einer Verbindung (gold).
Grafik: Dimitrios Fotiadis
Membranproteine befinden sich in den Wänden der Zellen, den Zellmembranen, und nehmen im menschlichen Körper lebenswichtige Funktionen wahr. Zu ihnen gehören die Transportproteine, die als eine Art «Türsteher» agieren, indem sie zum Beispiel Nährstoffe in die Zellen hinein- und Abfallprodukte aus den Zellen herauslassen.
Zahlreiche Transportproteine spielen bei menschlichen Krankheiten wie Krebs, Diabetes oder Depressionen Schlüsselrollen. Eine wichtige Klasse der Transportproteine bilden die Peptidtransporter der Darmzellen. Sie führen Abbauprodukte von Proteinen aus der Nahrung (Peptide) aus dem Darm durch die Zellmembranen in die Zellen hinein.
Der genaue Transportmechanismus ist aber noch weitgehend unerforscht, ebenso wie Peptide von den Transportern erkannt und «durchgeschleust» werden. Um dies klären zu können, sind atomare Modelle – und somit die Entschlüsselung der Struktur solcher «Türsteher» bei hoher Auflösung – von fundamentaler Bedeutung.
Strukturbiologen des Instituts für Biochemie und Molekulare Medizin der Universität Bern ist es nun gelungen, die hochaufgelöste Struktur eines Peptidtransporters zu entschlüsseln. So konnten wichtige offene Fragen zur molekularen Peptiderkennung beantwortet werden. Zudem sind die präsentierten strukturellen und funktionellen Erkenntnisse wertvoll für die Entwicklung von Arzneistoffen, zum Beispiel sogenannte «Prodrugs», die im Darm vereinfacht aufgenommen werden. Die Studie ist im Fachjournal «BioMed Central Biology» erschienen.
Grosse Herausforderung
Membranproteine sind komplexer als gewöhnliche Proteine, da sie sowohl wasser- wie auch fettliebende Bereiche besitzen. Diese chemische Eigenschaft ermöglicht ihre Verankerung in Membranen, macht sie aber biochemisch schwierig zu handhaben.
«Die Erforschung der 3D-Struktur von Membranproteinen ist extrem anspruchsvoll und stellt in der Strukturbiologie eine grosse Herausforderung dar», sagt Dimitrios Fotiadis vom Institut für Biochemie und Molekulare Medizin der Universität Bern und vom Nationalen Forschungsschwerpunkt (NFS) «TransCure». So wurde der Nobelpreis für Chemie 1988 Forschern für die Bestimmung der ersten hochaufgelösten Membranprotein-Struktur verliehen. Es folgten zwei weitere Nobelpreise für Chemie in den Jahren 2003 und 2012 für die Struktur und Funktion von Membranproteinen.
Das Forscherteam rund um Dimitrios Fotiadis hat die Struktur eines bakteriellen Peptidtransporters, der mit den menschlichen Transportern verwandt ist, entschlüsselt. Das Atommodell des Peptidtransporters konnte mittels Röntgenkristallographie bestimmt werden. Dafür müssen Proteine kristallisiert werden, was besonders bei Membranproteinkristallen sehr schwierig sein kann.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Kjel- / Dist Line von Büchi
Kjel- und Dist Line - Wasserdampfdestillation und Kjeldahl-Anwendungen
Maximale Genauigkeit und Leistung für Wasserdampfdestillation und Kjeldahl-Anwendungen

AZURA Purifier + LH 2.1 von KNAUER
Präparative Flüssigkeitschromatografie - Neue Plattform für mehr Durchsatz
Damit sparen Sie Zeit und verbessern die Reproduzierbarkeit beim Aufreinigen

Holen Sie sich die Analytik- und Labortechnik-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.