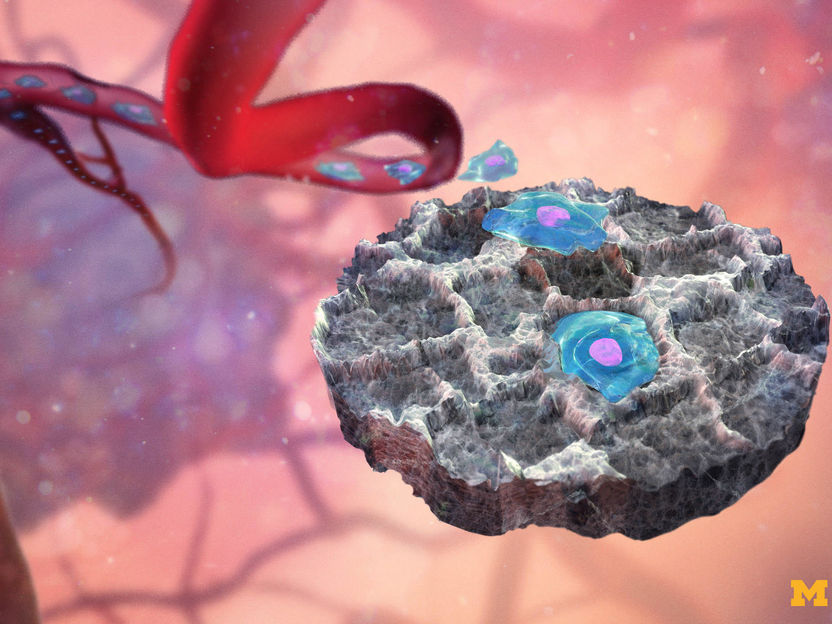
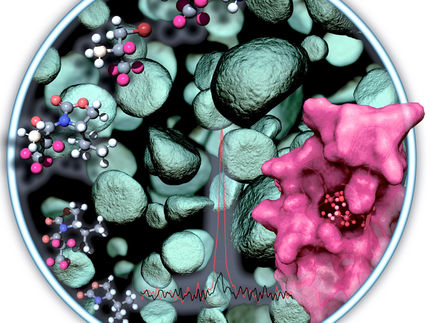
Neue Einblicke in Funktionsweise wichtiger Arzneimittelrezeptoren
Etwa dreißig Prozent aller Medikamente wie zum Beispiel Betablocker oder Antidepressiva wirken über bestimmte Membranproteine, sogenannte G-Protein-gekoppelte-Rezeptoren. In Zusammenarbeit mit Forschern des Paul-Scherrer-Instituts hat das Team von Prof. Stephan Grzesiek vom Biozentrum der Universität Basel nun im Detail aufgeklärt, wie sich die Struktur eines solchen Rezeptors bei der Bindung von Wirkstoffen verändert und so die Signalübertragung ins Zellinnere steuert.
Eine Vielzahl von Medikamenten wie Betablocker gegen Bluthochdruck oder Arzneistoffe zur Behandlung von Allergien, Krebs, Parkinson oder HIV binden an Proteine auf der Zelloberfläche, die zur Familie der G-Protein-gekoppelten-Rezeptoren gehören. Bindet ein Arzneistoff an einen solchen Rezeptor, so leitet dieser ein Signal ins Zellinnere weiter. Obwohl bereits zahlreiche Strukturen dieser Rezeptoren bekannt sind, war bis jetzt nicht klar, wie die Signale ins Innere einer Zelle übertragen werden.
Um die Art und Weise der Signalübertragung besser zu verstehen, hat das Team von Prof. Stephan Grzesiek am Biozentrum der Universität Basel nun gemeinsam mit Forschern des Paul-Scherrer-Instituts einen bestimmten Rezeptor – den sogenannten β1-Adrenorezeptor – genauer untersucht. Mithilfe der Kernmagnetresonanzspektroskopie (NMR) konnten sie verfolgen, wie die Struktur des Rezeptors auf verschiedene Wirkstoffe reagiert und erhielten damit ganz neue, detaillierte Einblicke in die Funktionsweise der gesamten Familie der G-Protein-gekoppelter-Rezeptoren.
Strukturänderungen geben Details über Rezeptorfunktion preis
Der β1-Adrenorezeptor ist ein Protein, das in der Membran von Herzzellen zu finden ist. Es fungiert als Übersetzer, denn durch das Andocken von Molekülen an der Zelloberfläche des Rezeptors werden Proteine im Zellinneren aktiviert. So löst zum Beispiel das Hormon Noradrenalin eine Signalkaskade aus, die schließlich zum Anstieg der Herzfrequenz und des Blutdrucks führt. Betablocker wirken dem entgegen, indem sie das Hormon daran hindern, an den β1-Adrenorezeptor anzudocken. Genaue Details, wie die Bindung von Molekülen an den Rezeptor dessen Struktur verändert und so die Signalübertragung moduliert, waren bislang jedoch unklar.
«Wir haben mittels hochauflösender NMR-Spektroskopie die strukturellen Veränderungen des β1-Adrenorezeptor nach Bindung verschiedener Wirkstoffen analysiert», erklärt Shin Isogai, Erstautor der Studie. «So konnten wir beobachten, wie der Rezeptor seinen Bindungspartner erkennt, dessen chemische Struktur interpretiert und durch die Änderung seiner eigenen Struktur diese Information anschließend ins Zellinnere weiterleitet. Diese Erkenntnisse über die Funktionsweise des β1-Adrenorezeptors lassen sich auf die ganze Familie der pharmakologisch bedeutsamen G-Protein-gekoppelten-Rezeptoren übertragen.»
Wirksamkeit von Arzneistoffen lässt sich vorhersagen
Durch die NMR-Analyse der Signale aus den Atomkernen konnten die Forscher feststellen, wie tief ein Wirkstoff in den Rezeptor eindringt, dabei einzelne Proteinteile beiseite schiebt, und wie dieses mechanische Signal ins Zellinnere übertragen wird. Dadurch konnten wichtige mechanische Verknüpfungen innerhalb der Rezeptorstruktur identifiziert werden, die für die Signalübertragung eine Rolle spielen. Die NMR-Daten geben auch ein direktes Maß für die Bindungsstärke der verschiedenen Wirkstoffe und für ihr Potenzial in der Zelle eine Antwort auszulösen. Es war sogar möglich, eine solche Antwort direkt beim Binden eines intrazellulären Signalproteins an den aktivierten Rezeptor zu verfolgen. «Da diese Rezeptoren extrem schwierig zu untersuchen sind, freut es uns umso mehr, dass wir nun erstmals solche Einzelheiten aufdecken konnten. Viele Wissenschaftler treibt das schon mehr als ein Jahrzehnt um», betont Isogai. «Wir werden die Technik nun zur Erforschung der Rolle einzelner Aminosäuren in der Signalübertragung sowie anderer Rezeptoren verwenden.» Zukünftig könnte die NMR-Methode auch bei der Entwicklung und Testen neuer Arzneimittel zum Einsatz kommen.
Originalveröffentlichung
Meistgelesene News
Originalveröffentlichung
Shin Isogai, Xavier Deupi, Christian Opitz, Franziska M. Heydenreich, Florian Brueckner, Gebhard F.X. Schertler, Dmitry B. Veprintsev and Stephan Grzesiek; "Backbone NMR reveals allosteric signal transduction networks in the β1-adrenergic receptor"; Nature; 2016
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft

Holen Sie sich die Analytik- und Labortechnik-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.
Meistgelesene News
Weitere News von unseren anderen Portalen
Zuletzt betrachtete Inhalte
Ausbau der „Weißen“ Biotechnologie hat in Deutschland gute Chancen - ECO SYS GmbH analysiert Eignung von Standorten und Produkten für den Ausbau der Fermentationsindustrie
Proteinnetzwerke auf dem Prüfstand für die medizinische Forschung - Saarbrücker Max-Planck-Wissenschaftler erstellen umfangreiche Qualitätsstudie zu menschlichen Proteininteraktionen

Erweiterte Möglichkeiten der Labordigitalisierung und -vernetzung - LABFORWARD fusioniert mit LABTWIN