Morsezeichen aus der Zelle
Wer sind die Moleküle, und wenn ja, wie viele? Für die komplexen Prozesse in biologischen Zellen müssen jeweils spezifische Moleküle in passender Menge am richtigen Ort zusammentreffen und interagieren. Eine hochauflösende Mikroskopietechnik, die Wissenschaftler am Max-Planck-Institut für Biochemie in Martinsried und der Harvard Universität, USA, entwickelt haben, weist die beteiligten Strukturen nach. Eine Weiterentwicklung dieser Methode analysiert nun erstmals auch die genaue Anzahl der verschiedenen Moleküle. Das ist wichtig, um zelluläre Mechanismen sowie krankhafte Veränderungen im Detail zu verstehen.

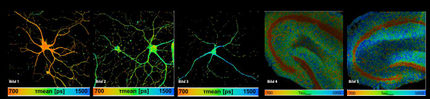
Die hochauflösende Mikroskopietechnik qPAINT erlaubt die Quantifizierung einzelner Moleküle. Durch Laserstrahlen in verschiedener Wellenlängen werden einzelne Farbstoffe sichtbar gemacht.
Maximilian Strauss © MPI of Biochemistry
Großbaustellen können chaotisch wirken, weil hunderte von Bauarbeitern in wechselnder Besetzung zusammenarbeiten und sich dabei von einer Stelle zur anderen bewegen. Ähnlich unübersichtlich sind die Vorgänge in Zellen, die Forscher buchstäblich im Dunkeln tappen lassen. Die mikroskopisch kleinen Moleküle können nur mit Hilfe von fluoreszierenden Farbstoffen aufgespürt werden, die an die gesuchte Struktur andocken und dann aufleuchten. Ralf Jungmann, der am Max-Planck-Institut für Biochemie und der Ludwig-Maximilians-Universität München die Gruppe „Molekulare Bildgebung und Bionanotechnologie” leitet, hat diesen Ansatz in mehreren Schritten weiterentwickelt. DNA-PAINT heißt das Verfahren, das es erlaubt, eine Vielzahl zelluläre Moleküle und ihre Interaktionen mit hoher Genauigkeit abzubilden.
Das gelingt, weil der Farbstoff und das gesuchte Molekül nicht direkt binden, sondern jeweils an einen kurzen DNA-Strang gekoppelt sind. Diese Abschnitte sind in ihrem Aufbau komplementär, so dass sie sich wie zwei Hälften eines Reißverschlusses zusammenfügen. Dann verrät der Farbstoff das Zielmolekül und dessen Position. Die Stärke der DNA-Bindung kann eingestellt werden. Ist sie schwach genug, lösen sich die beiden Stränge voneinander, und das Signal erlischt wieder. Nach dem sogenannten Exchange-PAINT-Ansatz können dann in nachfolgenden Schritten weitere Moleküle in der experimentell fixierten Zelle nachgewiesen werden.
So entstehen Schnappschüsse, die jeweils nur eine bestimmte zelluläre Struktur nachweisen. Übereinander gelegt entsteht aber in unerreicht hoher räumlicher Auflösung eine Art Gruppenfoto der zellulären Moleküle, die zu einem gegebenen Zeitpunkt zu einem gemeinsamen Prozess beitragen und dafür interagieren. Doch damit nicht genug: Bereits vor Jungmanns Wechsel an das MPI für Biochemie arbeitete er in einem Team unter der Leitung von Peng Yin vom Wyss Institute und der Harvard Medical School in Boston, USA, an einer Erweiterung der Methode, um die Komplexität der zellulären Vorgänge möglichst detailliert abzubilden.
Dafür ist nun mit der quantitativen Analyse ein wesentlicher Schritt gelungen. Wie die Forscher berichten, kann jetzt dank qPAINT erstmals auch die Anzahl der nachgewiesenen Moleküle präzise bestimmt werden. Dafür wird die Bindungsstärke der DNA-Stränge gezielt justiert. Sie ist so eingestellt, dass sich die Nukleinsäure-Abschnitte nach einer festgelegten Zeitspanne voneinander trennen. Dann sind sie frei für eine weitere Bindung, die den Farbstoff erneut zum Aufleuchten bringt. Abhängig von der Menge der Zielmoleküle kann sich dieser Zyklus aus Bindung und Trennung viele Male wiederholen - mit entsprechend häufigen Fluoreszenzsignalen.
Aus der Frequenz der molekularen Morsezeichen lässt sich mit Hilfe von qPAINT die exakte Anzahl der Moleküle in der Zelle errechnen, die jeweils zusammenwirken. Die Wissenschaftler hoffen, dass das neuartige Verfahren in viele Forschungsbereiche Einzug halten wird, auch weil es kostengünstiger als andere hochaufgelöste mikroskopische Ansätze ist. „Die genaue Anzahl spezifischer Moleküle ist bei vielen biologischen Prozessen und auch bei krankhaften Veränderungen wichtig", sagt Jungmann, der als einer der beiden Erstautoren der Studie genannt ist. „Bei vielen Störungen fallen Moleküle nicht ganz aus, sondern liegen in nur leicht veränderter Menge vor."