Schärfer als die Biologie erlaubt
Max-Planck-Forscher überlisten biologische Unschärferelation
Jeder, der schon mal ein Gruppenfoto gemacht hat, kennt das Problem: Wenn alle ständig durcheinanderlaufen, kann man kaum ein scharfes Bild schießen. Zellbiologen, die die molekularen Abläufe im Inneren einer Zelle sichtbar machen wollen, stehen vor einer ähnlichen Herausforderung. Die Moleküle bewegen sich mit hoher Geschwindigkeit hin und her: Rezeptoren werden innerhalb von Sekunden aktiviert, Vesikel transportieren Proteine in wenigen Minuten vom Rand der Zelle ins Zentrum. Forscher am Max-Planck-Institut für molekulare Physiologie in Dortmund haben nun einen Weg gefunden, einzelne Moleküle in lebenden Zellen genau zu lokalisieren und deren Aktivität, Bewegung und Wechselwirkungen zu messen. Sie versetzen die Zellen dazu in eine vorübergehende Kältestarre und erfassen den Stillstand mit einem hochauflösenden Fluoreszenzmikroskop. Durch Erwärmen können sie die Abläufe in der Zelle wieder weiterlaufen lassen und nach kurzer Zeit erneut anhalten. So setzen die Forscher aus mehreren Momentaufnahmen ein Gesamtbild der Bewegungs- und Aktivitätsmuster einzelner Moleküle innerhalb der Zelle zusammen.
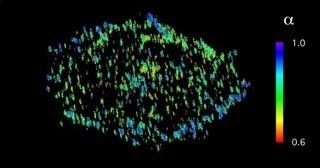
Dreidimensionales Fluoreszenzmikroskopie-Bild von der Aktivität des Ephrin-A2-Rezeptors in einer Zelle. Dieser Rezeptor kommt in manchen Hautkrebszellen in großen Mengen vor und beeinflusst die Metastasenbildung. Das bei Minusgraden aufgenommene Bild zeigt, dass das Protein auf kleinen Bläschen sitzt, die sich von der Zellmembran nach innen abschnüren.
© MPI f. molekulare Physiologie
Mit Fluoreszenzmikroskopen können Forscher einzelne Moleküle in Zellen beobachten. Jedoch gilt in der Biologie ein ähnliches Prinzip wie das, das Werner Heisenberg für die Quantenphysik formuliert hat: Je genauer man die Bewegung eines Teilchen betrachtet, desto schwieriger wird es, auch seine Position zu erfassen. In einem lebenden Organismus beobachten Forscher zwar die gemeinsame Bewegung vieler Moleküle, können die genaue Position jedes einzelnen Teilchens jedoch nur schwer bestimmen. Es klingt paradox: Um die molekulare Bewegungsmuster des Lebens zu untersuchen, müssen eben diese Bewegungen zunächst gestoppt werden.
Um ihre Struktur zu erhalten, wandeln Zellen Energie in molekulare Bewegung um. Diese Bewegung vieler einzelner kleiner Teilchen folgt bestimmten Mustern. Doch die Moleküle sind zu zahlreich und ihre Bewegungen zu schnell, als dass Fluoreszenzmikroskope sie alle genau erfassen könnten. Damit Wissenschaftler sie trotzdem beobachten können, können sie die genaue Position einzelner Moleküle entweder in toten und damit bewegungslosen Zellen bestimmen, oder sie verfolgen in lebenden Zellen die Bewegungsmuster mehrerer Moleküle. Bislang konnten Forscher Bewegungen in der Zelle durch Einfrieren oder chemische Fixierung zwar stoppen, jedoch war die Zelle danach nicht mehr lebensfähig. Die Fixierung führt zu irreparablen Schäden in der Zelle und Änderungen im Stoffwechsel. Aufnahmen, die nach einer solchen Fixierung entstanden sind, zeigen also oft nicht den Normalzustand einer lebenden Zelle.
Schonendes Abkühlen und Erwärmen
Die Wissenschaftler um Philippe Bastiaens vom Dortmunder Max-Planck-Institut haben nun jedoch eine Methode entwickelt, mit der sie Bewegungsmuster von Molekülen im Nanometerbereich doch beobachten können. Der Trick, der die Aufnahmen von Biomolekülen wie etwa Proteinen möglich macht, ist ein erzwungener Stillstand in lebenden Zellen. Dazu kühlen die Forscher die Zellen innerhalb kurzer Zeit so stark herunter, dass sie vollständig erstarren. „Cryo-Arrest“ nennt man diesen kältestarren Zustand, in dem genug Zeit für hochauflösende Aufnahmen bleibt. Durch stufenweise Zugabe und Entnahme eines Gefrierschutzmittels während des Abkühlens und Erwärmens können die Wissenschaftler die Zellen wieder zum Leben erwecken. Die biologischen Prozesse kommen wieder in Gang, und die Zellen leben weiter.
Die Forscher konnten die Zellen mehrmals hintereinander erstarren und wieder auftauen lassen und dadurch mehrere Momentaufnahmen zu einem Bewegungsmuster zusammensetzen. „Leben ist immer in Bewegung und daher unmöglich genau zu erfassen. Mit unserer Methode des reversiblen Cryo-Arrests ist uns das aber trotzdem gelungen. In gewisser Weise haben wir die biologische Unschärferelation außer Kraft gesetzt“, sagt Bastiaens, Leiter der Abteilung für systemische Zellbiologie.
Signalproteine lagern sich zusammen
Die Forscher haben so nicht nur die Position, sondern auch die Aktivität und Interaktionen einzelner Proteine gemessen. Dabei haben sie beispielsweise herausgefunden, wie die sogenannten EGF-Rezeptoren – Membranproteine, die Wachstumsfaktoren ins Innere der Zelle leiten und eine wichtige Rolle bei der Krebsentstehung spielen – sich häufig in Nanometer-großen Gruppen auf der Zelloberfläche zusammenlagern. Die Wissenschaftler vermuten, dass die Rezeptoren im Verbund besonders effektiv aktiviert werden können und ein stärkeres Wachstumssignal ins Innere der Zelle senden.
In einem nächsten Schritt wollen Bastiaens und seine Mitarbeiter das Verfahren daher noch weiter verbessern und den Abkühlprozess von mehreren Minuten auf wenige Millisekunden beschleunigen. Bei dem schnellen Verfahren könnte sogar ganz auf den Einsatz des giftigen Gefrierschutzmittels verzichtet werden.
Originalveröffentlichung
Martin E. Masip, Jan Huebinger, Jens Christmann, Ola Sabet, Frank Wehner, Antonios Konitsiotis, Günther R. Fuhr, and Philippe I. H. Bastiaens; "Reversible cryo-arrest for imaging molecules in living cells at high spatial resolution"; Nature Methods; 11 July, 2016
Diese Produkte könnten Sie interessieren
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Fluoreszenzmikroskopie
Die Fluoreszenzmikroskopie hat die Life Sciences, Biotechnologie und Pharmazie revolutioniert. Mit ihrer Fähigkeit, spezifische Moleküle und Strukturen in Zellen und Geweben durch fluoreszierende Marker sichtbar zu machen, bietet sie einzigartige Einblicke auf molekularer und zellulärer Ebene. Durch ihre hohe Sensitivität und Auflösung erleichtert die Fluoreszenzmikroskopie das Verständnis komplexer biologischer Prozesse und treibt Innovationen in Therapie und Diagnostik voran.

Themenwelt Fluoreszenzmikroskopie
Die Fluoreszenzmikroskopie hat die Life Sciences, Biotechnologie und Pharmazie revolutioniert. Mit ihrer Fähigkeit, spezifische Moleküle und Strukturen in Zellen und Geweben durch fluoreszierende Marker sichtbar zu machen, bietet sie einzigartige Einblicke auf molekularer und zellulärer Ebene. Durch ihre hohe Sensitivität und Auflösung erleichtert die Fluoreszenzmikroskopie das Verständnis komplexer biologischer Prozesse und treibt Innovationen in Therapie und Diagnostik voran.





























































