Neuer Biomarker für Krebsimmuntherapie?
Der Ligand PD-L1 gehört zu den wichtigsten Zielstrukturen der Krebsimmuntherapie mit Checkpoint-Inhibitoren. Wissenschaftler des Deutschen Konsortiums für Translationale Krebsforschung (DKTK) haben nun gezeigt, dass sich verschiedene Krebsarten in der Anzahl der PD-L1-Genkopien unterscheiden. genetische Analysen des PD-L1-Gens könnten somit möglicherweise künftig helfen, vorherzusagen, welche Patienten von Checkpoint-Inhibitoren profitieren. Im DKTK verbindet sich das Deutsche Krebsforschungszentrum (DKFZ) als Kernzentrum langfristig mit onkologisch besonders ausgewiesenen universitären Partnerstandorten und Kliniken in Deutschland.
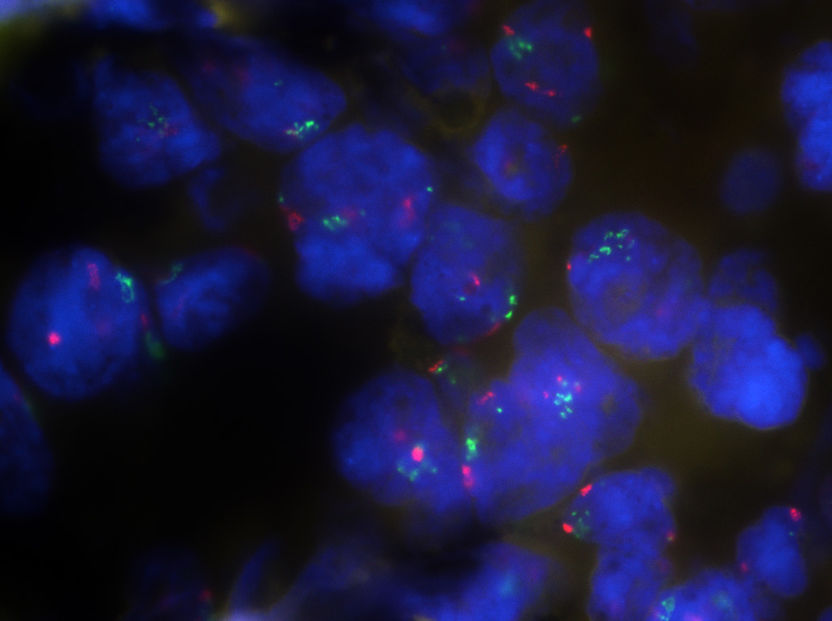
Unterschiedliche Anzahl der PD-L1-Genkopien (grün) in den Chromosomen (blau) von Blasentumorzellen (Fluoreszenz in-situ Hybridisierung).
Quelle: J. Budczies, Charité Berlin / A. Stenzinger, Uniklinikum Heidelberg
Bereits vor hundert Jahren stellten Wissenschaftler die These auf, dass das Immunsystem Krebszellen erkennen und beseitigen kann. Doch erst mit den „Checkpoint-Inhibitoren“ gelang vor wenigen Jahren ein entscheidender Durchbruch. Sie wirken an den Immunkontrollpunkten des Immunsystems, auch Checkpoints genannt. Beim gesunden Menschen verhindern diese Kontrollpunkte, dass es zu einer überschießenden Abwehrreaktion kommt. Tumoren missbrauchen diese Immunkontrollpunkte, um die gegen sie gerichtete Immunabwehr zu unterdrücken. Hier greifen Checkpoint-Inhibitoren ein: Sie hemmen den Signalweg, lösen also gewissermaßen die Bremsen des Immunsystems und geben damit der Körperabwehr wieder die Möglichkeit, den Tumor zu attackieren.
PD-L1 lässt sich für diagnostische Tests nutzen
Als vielversprechende Zielstruktur für die Behandlung von Tumoren mit Checkpoint-Inhibitoren gilt der auf T-Zellen vorhandene Rezeptor „programmed cell death 1 (PD-1)“ und sein Ligand, PD-L1, der auf den meisten Tumorzellen vorkommt. Erste Medikamente, die die tumorbedingte Bremse der Immunabwehr über diesen Checkpoint aufheben, sind bereits auf dem Markt. „PD-L1 ist zudem ein interessanter Biomarker für diagnostische Tests, um vorherzusagen, wie gut Patienten auf die Immuntherapie ansprechen werden“, erklärt der Bioinformatiker Jan Budczies der DKTK Partnereinrichtung Charité Berlin. „Aktuelle Studien zeigen jedoch, dass die Zusammenhänge sehr komplex sind.“ Demnach sprechen nicht alle Patienten, bei denen PD-L1 im Tumorgewebe nachgewiesen wurde, auf eine Therapie mit PD-L1-Blockern an. Umgekehrt gab es auch bei Patienten Behandlungserfolge, bei denen sich kaum PD-L1-Protein in den Tumoren nachweisen ließ.
Tumoren verschiedener Krebsarten unterscheiden sich in der Anzahl der PD-L1-Genkopien
Gemeinsam mit DKTK-Wissenschaftlern der Standorte Berlin, München und Heidelberg zeigte das Team um Jan Budczies und den Pathologen Albrecht Stenzinger, dass Tumoren zahlreicher Krebsarten sich in der Anzahl der Kopien des PD-L1-Gens unterscheiden. In den Tumorgenomen von 9771 Patienten mit 22 unterschiedlichen Krebserkrankungen, darunter auch die häufigsten Krebsarten wie Lungen-, Darm- und Brustkrebs, fanden die Krebsforscher veränderte Kopienzahlen des PD-L1-Gens und benachbarter Gene. Wurden Genkopien vervielfacht oder gingen verloren, so beeinflusste das in vielen Fällen auch die Genaktivität und die Menge des PD-L1 Proteins im Tumor, wie die Studie zeigte.
Mit der Studie wollen die Wissenschaftler dazu beitragen, diagnostische Tests für den Einsatz von Immuncheckpoint-Inhibitoren zu optimieren und die Tumorbiologie im Hinblick auf die Immuntherapie und andere Therapieverfahren besser zu verstehen. „Wir konnten zeigen, dass die Anzahl der PD-L1 Genkopien in ganz unterschiedlichen Krebsarten verändert sein kann“, sagt Albrecht Stenzinger vom Institut für Pathologie des Universitätsklinikum Heidelberg und dem Nationalen Centrum für Tumorerkrankungen (NCT). „Das betrifft nicht nur PD-L1 selbst, sondern zahlreiche benachbarte Gene, von denen einige bereits als Treibergene für Tumorerkrankungen bekannt sind. Die meisten Tumoren mit erhöhter PD-L1 Genkopienzahl besitzen beispielsweise auch mehr Kopien des Gens für die Kinase JAK2, die eine Rolle bei Erkrankungen des Blutes spielt und kürzlich auch als Zielstruktur in einem prognostisch ungünstigen Brustkrebs-Subtyp identifiziert worden ist.“
PD-L1 Genkopienzahl hat das Potential zum Biomarker
Erbgut-Analysen könnten demnach dazu beitragen, weitere Zielstrukturen in der Nachbarschaft von PD-L1 zu erkennen. „Derartige Studien sind hochkomplex und können nur von einem interdisziplinären Team aus Medizinern und Grundlagenforschern durchgeführt werden. Das DKTK bietet hierfür die ideale Umgebung, indem es die Expertise von Onkologen, Bioinformatikern und Pathologen zusammenführt“, sagt Albrecht Stenzinger. Jan Budczies, der für den bioinformatischen Teil der Studie verantwortlich ist, betont: „Big Data-Analysen sind ein wichtiges Werkzeug der modernen Medizin. Nur wenn Wissenschaftler fächerübergreifend zusammenarbeiten, können wir die daraus resultierenden Ergebnisse schnell in einen Nutzen für die Patienten übersetzen.“
Die Analyse der PD-L1-Genkopien und der PD-L1-Rezeptoren könnte dabei helfen, Patienten zu identifizieren, die von der Immuntherapie mit Checkpoint-Inhibitoren besonders profitieren. Dass die Analyse der PD-L1-Kopienzahl für die klinische Praxis relevant ist, zeigen bereits zwei kürzlich veröffentliche Studien zum Hodgkin Lymphom. Sowohl der Verlauf der Erkrankung als auch der Behandlungserfolg mit Blockern des PD-1-Signalweges ließ sich anhand der Kopienzahl der PD-L1-Gene vorhersagen. Die Arbeit von Budczies und Stenzinger legt nahe, dass dies auch bei zahlreichen anderen Krebsarten der Fall sein könnte.