Einzelne Proteine bei der Arbeit beobachten
Neuer Ansatz, um Strukturen und Bewegungen komplexer Moleküle zu veranschaulichen
Wissenschaftler der Universität Freiburg und der Technischen Universität München haben am Beispiel des Hitzeschockproteins Hsp90 einen Ansatz entwickelt, der neue Einsichten in die Dynamiken komplexer Moleküle ermöglicht. Hsp90 besteht aus mehreren funktional und strukturell voneinander unabhängigen Abschnitten, so genannten Domänen. Diese interagieren unter anderem mit Regulatoren des Zellstoffwechsels wie etwa dem Protein p53. Bislang war es nur möglich, von komplexen Molekülen wie Hsp90 entweder hochaufgelöste statische oder niedrig aufgelöste bewegliche Bilder zu erzeugen. Dem Team ist es nun gelungen, mithilfe von Fluoreszenz hoch aufgelöste bewegte Bilder zu erzeugen, die Hsp90 bei der Arbeit zeigen. Dabei haben die Wissenschaftler herausgefunden, dass Substratproteine die Bewegungen von Hsp90 kontrollieren können. „Wir sind überzeugt, dass unsere Methode schon bald ein unverzichtbares Werkzeug der Strukturbiologie zur Analyse von Proteinen sein wird“, sagt Prof. Dr. Thorsten Hugel vom Institut für Physikalische Chemie der Universität Freiburg.
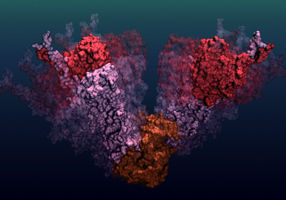
Dynamisches Ensemble: Die Grafik zeigt ein Ensemble möglicher Strukturen, die das molekulare Chaperon Hsp90 im offenen Zustand annehmen kann. Die neu entwickelte Methode erlaubt es nicht nur, solch ein Ensemble, sondern auch die Dynamik, also die Zeitskala der Strukturänderungen, zu bestimmen.
Quelle: B. Hellenkamp, F. Kandzia und W. Schürmann
Das molekulare Chaperon Hsp90 steuert viele grundlegende Prozesse in menschlichen Zellen entscheidend. Unter anderem ist es maßgeblich daran beteiligt, dass einfache Aminosäureketten zu funktionierenden Proteinen mit einer definierten Struktur gefaltet werden. Damit Hsp90 seine Aufgaben erfüllen kann, wirken die einzelnen Domänen mit unterschiedlichen Proteinen zusammen. Hugel und sein Team wollen ein dynamisches Bild dieser Zusammenarbeit von Proteinen in Echtzeit gewinnen. Daher arbeiten sie an der Entwicklung neuer Methoden, die es ihnen ermöglichen, die komplexen, mit hoher Geschwindigkeit ablaufenden Prozesse abzubilden und zu analysieren.
Die bisherige Betrachtungsweise nahm einige wenige Zustände in den Fokus, in denen Hsp90 vorliegen kann – zum Beispiel offen und geschlossen. Die Ergebnisse der Forscher aus Freiburg und München zeigen, dass diese Betrachtung um eine dynamische Sichtweise erweitert werden muss: Ziel ist es, das Ensemble möglicher Strukturen, die das Protein annehmen kann, genauer zu beschreiben und dabei insbesondere die zeitliche Dimension zu berücksichtigen (siehe Abbildung).
Originalveröffentlichung
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Proteinanalytik
Die Proteinanalytik ermöglicht einen tiefen Einblick in diese komplexen Makromoleküle, ihre Struktur, Funktion und Wechselwirkungen. Sie ist unerlässlich für die Entdeckung und Entwicklung von Biopharmazeutika, das Verständnis von Krankheitsmechanismen und die Identifizierung von therapeutischen Zielen. Durch Techniken wie Massenspektrometrie, Western Blot und Immunoassays können Forscher Proteine auf molekularer Ebene charakterisieren, ihre Konzentration bestimmen und mögliche Modifikationen identifizieren.

Themenwelt Proteinanalytik
Die Proteinanalytik ermöglicht einen tiefen Einblick in diese komplexen Makromoleküle, ihre Struktur, Funktion und Wechselwirkungen. Sie ist unerlässlich für die Entdeckung und Entwicklung von Biopharmazeutika, das Verständnis von Krankheitsmechanismen und die Identifizierung von therapeutischen Zielen. Durch Techniken wie Massenspektrometrie, Western Blot und Immunoassays können Forscher Proteine auf molekularer Ebene charakterisieren, ihre Konzentration bestimmen und mögliche Modifikationen identifizieren.