Der erste Blick auf ein einzelnes Protein
Mit Elektronen-Hologrammen lässt sich ein gefaltetes Eiweißmolekül zerstörungsfrei abbilden
Proteine sind die Werkzeuge des Lebens. Wie sie aufgebaut sind, wie sie ihre Aufgaben in einer Zelle erfüllen und wo möglicherweise medizinische Wirkstoffe an ihnen angreifen, könnte sich künftig auf besonders schonende Weise an einzelnen Exemplaren der Biomoleküle untersuchen lassen. Möglich machen das Hologramme von Proteinen, die Wissenschaftler der Universität Zürich und des Max-Planck-Instituts für Festkörperforschung in Stuttgart nun erstmals mit besonders langsamen Elektronen aufgenommen haben.
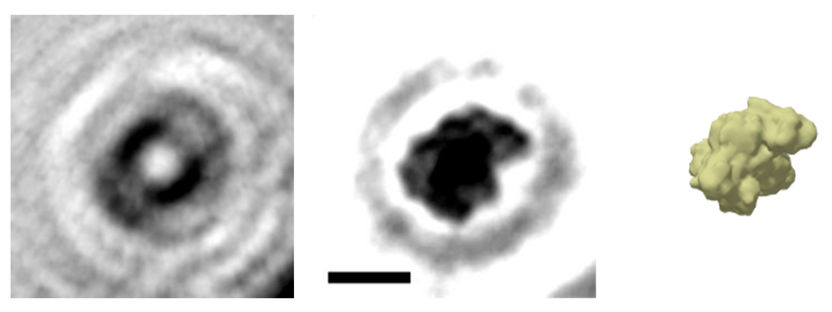
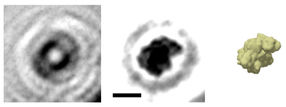
Das holografische Bild eines einzelnen Proteins: Aus dem Hologramm (links) wird das Bild des Proteins Albumin (Mitte) berechnet (Der Balken entspricht fünf Nanometern). Das Prinzip kann man sich in etwa so vorstellen, als würde man die Wellen eines ins Wasser geworfenen Steins zurückverfolgen und daraus die Form des Steins rekonstruieren. Wie der Vergleich mit einer Simulation der Elektronendichte zeigt, gibt die holografische Abbildung die globale Struktur des Proteins sehr gut wieder.
© Jean-Nicolas Longchamp/Universität Zürich
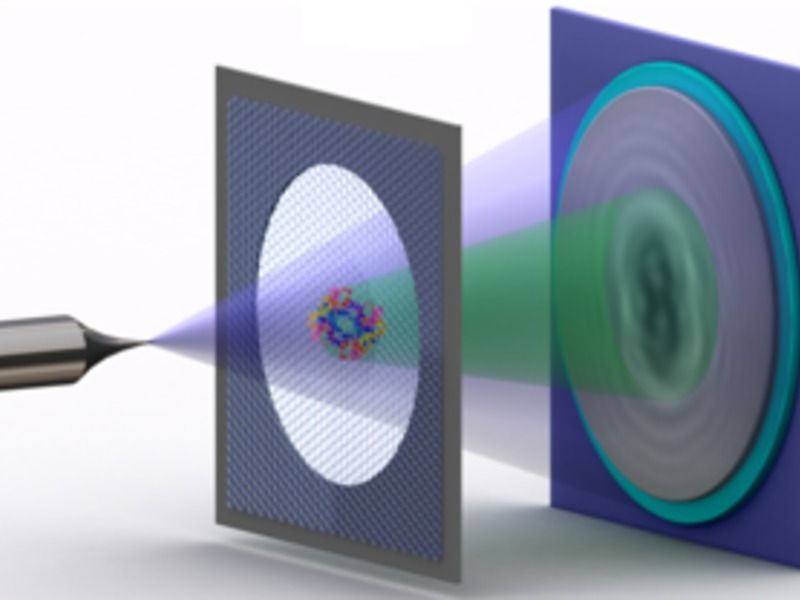
Schema der Elektronen-Holografie einzelner Proteine: Eine Metallspitze, deren Ende nur aus wenigen Atomen besteht, sendet einen Strahl vergleichsweise langsamer, also energiearmer Elektronen aus. Einen Teil des Strahls wird an dem Protein auf einem Graphen-Träger gestreut. Der gestreute Teil des Strahls erzeugt mit dem nicht-gestreuten Teil dann ein Interferenzmuster – das Hologramm, das aufgezeichnet wird.
© Tatiana Latychevskaia /Universität Zürich

Die Struktur von Proteinen zu kennen, ist nicht nur für Biologen interessant, die verstehen wollen, wie ein Organismus funktioniert. Auch Mediziner und Pharmakologen müssen wissen, wie Proteine aufgebaut sind, an welche Teile von ihnen andere Proteine oder kleinere Moleküle andocken und wie diese Bindungsstellen sich während der Arbeit des Proteins verändern. Denn mit diesem Wissen, können die Forscher medizinische Wirkstoffe entwickeln, die in die Protein-Maschinerie eingreifen, wenn diese nicht richtig funktioniert und wir krank werden.
Der Blick auf einzelne Proteine, ist dabei besonders hilfreich: Gängige Methoden wie die Röntgenstrukturanalyse und die Kryo-Elektronenmikroskopie sind auf Kristalle der Biomoleküle angewiesen beziehungsweise mitteln über Aufnahmen vieler Exemplare eines Proteins. Nicht nur, dass sich von vielen Proteinen keine Kristalle züchten lassen, mit diesen Methoden lassen sich auch die Unterschiede zwischen verschiedenen Konformationen, also Strukturvarianten des Biomoleküls oft nicht erkennen. Gerade diese Variationen sind für die Suche nach Arzneistoffen jedoch wichtig, weil das Protein bei vielen Arbeitsschritten verschiedene Konformationen annimmt.
Die ursprüngliche Idee der Holografie wird jetzt Wirklichkeit
„Wir haben jetzt erstmals einzelne Protein abgebildet“, sagt Hans-Werner Fink, Professor an der Universität Zürich und Leiter des Experiments. „Möglich wurde das, weil wir zwei weltweit einzigartige Methoden kombiniert haben: die Elektronen-Holografie und die Elektrospray-Ionenstrahl-Deposition, mit der sich Proben besonders sanft präparieren lassen.“ Mit dieser Kombination erzeugten die Forscher Hologramme von Cytochrom C, Albumin und Hämoglobin. Da deren Strukturen bereits bekannt sind, konnten sie an diesen Proteinen überprüfen, wie aussagekräftig die Hologramme sind.
Für die Elektronen-Holografie haben die Zürcher Forscher um Hans-Werner Fink ein neuartiges Mikroskop entwickelt, das die Welleneigenschaften von Elektronen ausnutzt. Das Mikroskop schickt Elektronen mit niedriger Energie durch ein Protein und überlagert die derart gestreuten Elektronen mit dem Teil des Elektronenstrahls, der mit dem Protein nicht interagiert hat. Das Interferenzmuster, das dabei entsteht und das von dem Mikroskop aufgezeichnet wird, ist das Hologramm – ganz so, wie man es von der optischen Holgrafie kennt. „Weil die Elektronen nur wenig Energie besitzen, gibt es dabei anders als bei anderen Methoden der Strukturanalyse kaum Strahlenschäden, selbst wenn wir ein Protein stundenlang abbilden“, sagt Hans-Werner Fink.
Mit dem Elektronen-Holografie-Mikroskop hat der Physiker die ursprüngliche Idee von Dennis Gábor verwirklicht. Als der ungarisch-britische Ingenieur 1947 die Holografie erfand, hatte er nämlich eigentlich ein verbessertes Elektronenmikroskop im Sinn. Es gab damals jedoch keine geeigneten Elektronenquellen, sodass sich dieses neue Prinzip der optischen Abbildung nach der Erfindung des Lasers zunächst nur mit Licht in die Praxis umsetzen ließ. Dafür erhielt Dennis Gabor im Jahre 1971 den Physik-Nobelpreis. „Nach der Erfindung einer atomar scharfen Elektronenpunktquelle, die Elektronen mit ähnlichen Eigenschaften abgibt wie ein Laser Licht, konnten wir die geniale Idee von Dennis Gabor schließlich auch mit Elektronenwellen realisieren“, sagt Hans-Werner Fink.
Das gasförmige Protein wird sanft auf Graphen platziert
Um mit der Elektronen-Holografie jedoch auch einzelne Proteine abbilden zu können, brauchten die Schweizer Forscher noch ein Trägermaterial für die Proteine, das für die Elektronenwellen durchsichtig ist, und eine Methode, die Biomoleküle darauf unbeschadet zu platzieren. Für den Träger erwies sich Graphen als am besten geeignet. Und um die Proteine auf die Blätter aus einzelnen Kohlenstofflagen zu bringen, hatten Wissenschaftler des Max-Planck-Instituts für Festkörperforschung die optimale Lösung: die Elektrospray-Ionenstrahl-Deposition, die ein Team um Stephan Rauschenbach in der Abteilung von Klaus Kern entwickelt hat. Dabei legen die Forscher an die Lösung von Proteinen eine hohe elektrische Spannung an, sodass sich die Flüssigkeit stark auflädt und durch die elektrische Abstoßung zu einem feinen Nebel zerstäubt wird. Wenn die Nebeltröpfchen anschließend in ein Vakuum geleitet werden, verdampft die Flüssigkeit, als Gase zurück bleiben die gelösten Bestandteile, also Proteine und mögliche Verunreinigungen. Anschließend sortiert ein Massenspektrometer die Proteine nach deren Verhältnis von Masse zu Ladung und trennt außerdem die Verunreinigungen ab.
„Unsere Methode erlaubt es, einzelne biologische Moleküle so sanft ins Vakuum zu überführen und auf einer Oberfläche zu deponieren, dass die fragile, dreidimensional gefaltete Proteinstruktur erhalten bleibt“, sagt Stephan Rauschenbach. „Durch die präparative Massenspektrometrie verhindern wir außerdem Verunreinigungen der Graphenträger mit anderen Molekülen, was entscheidend für die Qualität der holographischen Abbildung ist.“ Die Massenspektrometrie ermöglicht es darüber hinaus, Gemische von Proteinen oder die reinen Proteine von den Komplexen mit ihren Bindungspartnern zu separieren.
Informationen über die Verknüpfung von Untereinheiten
Sobald Stephan Rauschenbach und seine Mitarbeiter die Proteine in Stuttgart auf die Graphenträger gebracht haben, müssen die Proben allerdings noch ins Elektronen-Holografie-Mikroskop nach Zürich gelangen, und zwar unverschmutzt, was hier heißt, dass sich keine anderen Moleküle auf das Graphen setzen dürfen. Zu dem Zweck haben die Forscher einen Koffer entwickelt, in dem wie in ihren Apparaturen ein extrem gutes Vakuum herrscht und in dem sie die Proben in die Schweiz transportieren.
Nicht zuletzt wegen der großen Sorgfalt und Sauberkeit bei der Präparation und beim Transport der Proben, erreichen die Wissenschaftler mit den Elektronen-Hologrammen schon jetzt eine Auflösung von weniger als einem Nanometer. „Damit können wir bereits untersuchen, wie die einzelnen Untereinheiten größerer Proteinkomplexe miteinander verbunden sind“, sagt Stephan Rauschenbach. Auch über die dreidimensionale Struktur geben die ersten Hologramme einzelner Proteine bereits Auskunft.
„Um die Struktur aber auf das einzelne Atom genau abbilden zu können, müssen wir die Auflösung noch etwas verbessern“, erklärt Klaus Kern „Dafür gibt es aber keine physikalischen Hindernisse.“ So planen die Zürcher und Stuttgarter Wissenschaftler ein Mikroskop zu konstruieren, in dem sich Schwingungen der Proteine durch Kühlung auf etwa minus 200 Grad Celsius unterdrücken lassen. Zudem gibt es seit kurzem ein einzigartiges Präzisionslabor am Stuttgarter Max-Planck-Institut, das für hochempfindliche Messungen wie die Holographie perfekte Bedingungen bietet. Dieses Labor wurde auf Initiative von Klaus Kern errichtet und setzt derzeit den Standard für eine vibrationsarme Messumgebung. Spätestens sobald sie das Elektronen-Holografie-Mikroskop mit Möglichkeiten, wie sie dort geboten werden, optimiert haben, können Biomediziner mit diesem neuen Instrument untersuchen, wie die Werkzeuge des Lebens im Detail funktionieren.
Originalveröffentlichung
Jean-Nicolas Longchamp, Stephan Rauschenbach, Sabine Abb, Conrad Escher, Tatiana Latychevskaia, Klaus Kern und Hans-Werner Fink; "Imaging proteins at the single molecule level"; Proceedings of the National Academy of Sciences; im Druck