Molekularer Aufbau des Zellkern-Skeletts erstmals aufgeklärt
Mittels 3-D-Elektronenmikroskopie konnten Strukturbiologen der Universität Zürich erstmals die Architektur der Lamina des Zellkerns in molekularer Auflösung darstellen. Dieses Gerüst stabilisiert den Zellkern höherer Lebewesen und ist bei der Organisation, Aktivierung und Duplizierung des Erbmaterials beteiligt. Schwere Krankheiten wie Muskelschwund oder vorzeitige Vergreisung, die durch Mutationen in den Laminen, den Hauptbestandteilen der Lamina, verursacht werden, lassen sich nun besser erforschen.
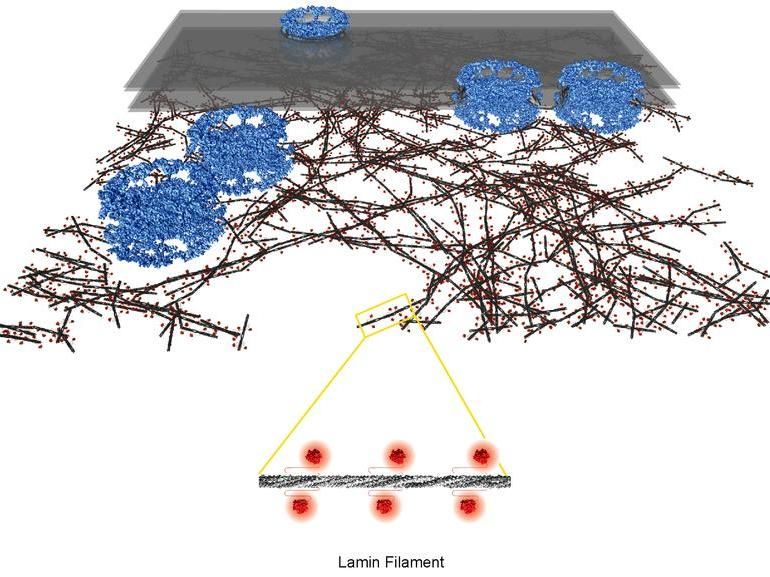
Nukleäre Lamina: Architektur des filigranen Geflechts aus Lamin-Filamenten (Filamentstamm dunkelgrau, globuläre Domänen rot) unterhalb Zellkernmembran (transparent grau) und Kernporenkomplexe (blau).
Yagmur Turgay, Universität Zürich
Im Gegensatz zu Bakterien befindet sich das genetische Material von höheren Lebewesen im Zellkern bzw. Nukleus. Dessen äussere Hülle besteht aus der Zellkernmembran, in der zahlreiche Poren eingebettet sind. Durch diese Transportkanäle werden Moleküle in den Zellkern hinein bzw. von dort hinaus befördert. Unterhalb der Membran liegt die nukleäre Lamina, ein fadenartiges Geflecht von einigen Millionstel Millimetern Dicke. Dieses stabilisiert den Zellkern und schützt die darunterliegende DNA vor äusseren Einflüssen. Zudem spielt die Lamina eine wichtige Rolle bei essenziellen Prozessen im Zellkern – etwa die Organisation der Chromosomen, die Aktivität von Genen sowie die Verdoppelung des Erbmaterials vor der Zellteilung.
Detaillierte 3-D-Darstellung des Zellkern-Gerüsts in natürlicher Form
Nun konnten Forschende des Biochemischen Instituts der UZH unter der Leitung des Zellbiologieprofessors Ohad Medalia erstmals die molekulare Architektur der Zellkern-Lamina von Säugetierzellen im Detail aufklären. Die Wissenschaftler untersuchten Bindegewebszellen von Mäusen mittels Kryo-Elektronentomografie. «Dieses Verfahren kombiniert Elektronenmikroskopie und Computertomografie und erlaubt es, Zellstrukturen in einem quasi-natürlichen Zustand in Molekülauflösung dreidimensional sichtbar zu machen», erläutert Yagmur Turgay, Erstautor der Studie. Die Zellen werden – ohne Vorbehandlung mit schädlichen Chemikalien – in flüssigem Ethan bei -190 °C schockgefroren, wodurch die Zellstrukturen in ihrem ursprünglichen Zustand erhalten bleiben.
«Das Lamin-Geflecht entspricht einer rund 14 Nanometer dicken Schicht, die sich direkt unterhalb der Porenkomplexe der Zellkernmembran befindet und die aus mehr oder weniger dicht gepackten Regionen besteht», beschreibt Yagmur Turgay die Architektur des Zellkern-Skeletts. Aufgebaut ist das Gerüst aus dünnen, fadenförmigen Gebilden unterschiedlicher Länge – den Lamin-Filamenten. Mit einer Dicke von nur 3,5 Nanometern sind die Filamente der Lamina viel dünner und filigraner als die Strukturen, die bei höheren Organismen das Zellskelett ausserhalb des Zellkerns bilden.
Neuer Ansatz für die Erforschung von Progerie und Muskelschwund
Die Grundbausteine der Filamente sind zwei Eiweisse – die Lamin-Proteine des Typs A und B – die sich aneinanderlagern. Diese bestehen aus einem länglichen Stamm und einer globulären Domäne; ähnlich einer Stecknadel mit Stecknadelkopf. Schon einzelne Mutationen im Lamin-Gen führen zu ganz unterschiedlichen, schweren Krankheiten wie vorzeitiges Altern (Progerie), Muskelschwund (Muskeldystrophien), Fehlverteilung des Fettgewebes (Lipodystrophien) und Erkrankungen des Nervensystems (Neuropathien). «Die Kryo-Elektronentomografie erlaubt es uns, zukünftig die strukturellen Unterschiede der nukleären Lamina von gesunden Menschen und von Patienten mit Mutationen im Lamin-Gen detailliert zu untersuchen», sagt Ohad Medalia. Diese Methode, so der Strukturbiologe, erlaube die Entwicklung neuer Krankheitsmodelle auf molekularer Ebene, die den Weg hin zu neuen therapeutischen Massnahmen eröffne.
Originalveröffentlichung
Meistgelesene News
Originalveröffentlichung
Yagmur Turgay, Matthias Eibauer, Anne E. Goldman, Takeshi Shimi, Maayan Khayat, Kfir Ben-Harush, Anna Dubrovsky-Gaupp, K. Tanuj Sapra, Robert D. Goldman, Ohad Medalia; "The molecular architecture of lamins in somatic cells"; Nature; 2017
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Kjel- / Dist Line von Büchi
Kjel- und Dist Line - Wasserdampfdestillation und Kjeldahl-Anwendungen
Maximale Genauigkeit und Leistung für Wasserdampfdestillation und Kjeldahl-Anwendungen

AZURA Purifier + LH 2.1 von KNAUER
Präparative Flüssigkeitschromatografie - Neue Plattform für mehr Durchsatz
Damit sparen Sie Zeit und verbessern die Reproduzierbarkeit beim Aufreinigen

Holen Sie sich die Analytik- und Labortechnik-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.