Molekulare Kraftmesser
Proteine werden häufig als molekulare Maschinen der Zellen beschrieben. Um ihre Funktionsweise zu verstehen, reicht es häufig nicht aus, sich die beteiligten Proteine unter dem Mikroskop anzuschauen. Dort, wo Maschinen arbeiten treten mechanische Kräfte auf, die wiederum Einfluss auf die jeweiligen biologische Prozesse nehmen. Diese extrem kleinen Kräfte können dank molekulare Kraftsensoren in den Zellen gemessen werden. Jetzt haben Forscher am Max-Planck-Institut für Biochemie molekulare Sensoren entwickelt, die intrazellulär auftretende Kräfte mehrerer Proteine in höchster Auflösung im Pikonewton-Bereich messen können.
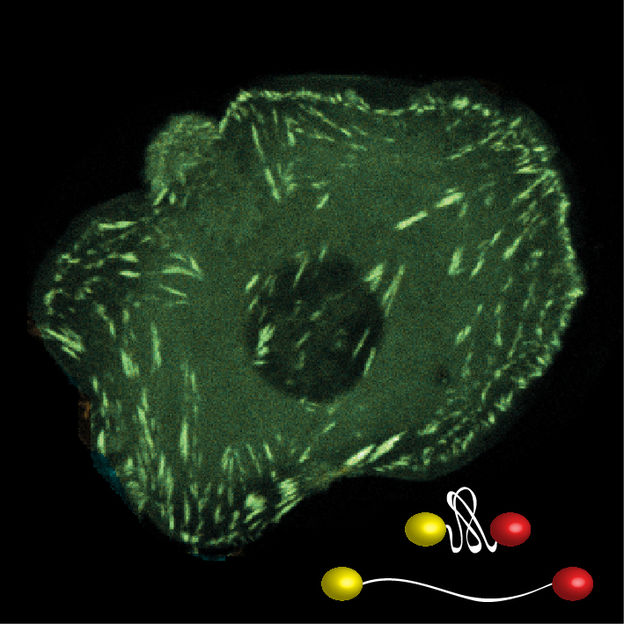
Die Entwicklung neuer Fluoreszenz-basierter Biosensoren, welcher unter mechanischer Kraft entfalten, erlaubt die Vermessung molekularer Kräfte entlang spezifischer Strukturen in lebenden Zellen.
© MPI für Biochemie
Sobald Proteine aneinander ziehen, wirken Kräfte im Pikonewtonbereich. Zellen können solche mechanischen Informationen detektieren und je nach Art des Signals unterschiedlich reagieren. Haftproteine an der Oberfläche von Zellen erkennen zum Beispiel, wie starr ihre Umgebung ist und passen die Proteinzusammensetzung der Zelle an. Um diese minimal wirkenden Kräfte messen zu können, entwickelt die Arbeitsgruppe „Molekulare Mechanotransduktion“ am Max-Planck-Institut molekulare Sensoren. „Diese kleinen Messgeräte funktieren ähnlich wie eine Federwaage“, so Carsten Grashoff, Leiter der Forschungsgruppe.
Der neu entwickelte Sensor besteht aus zwei fluoreszenten Molekülen, die mit einer Art molekularer Feder verbunden sind. Wirkt auf das Molekül eine Kraft von nur wenigen Pikonewton wird die Feder gespannt, was mit einem speziellen Mikroskopieverfahren ausgelesen werden kann. „Wir sind jetzt in der Lage, die Mechanik mehrerer Moleküle gleichzeitig zu vermessen“, erklärt Carsten Grashoff. Verglichen mit früheren Sensoren können die Wissenschaftler jetzt sagen, welche Proteine unter Kraft stehen und wie viele.
„Beim Tauziehen ziehen vielen Menschen unterschiedlich stark an einem Seil. Einige ruhen sich vielleicht aus und lassen den Vordermann die Arbeit machen. Bei den Proteinen ist das ganz ähnlich. Wir können jetzt ermitteln, welche Proteine zur zellulären Kraftentwicklung beitragen und welcher Prozentsatz dieser Moleküle eigentlich mitmacht“ , erklärt Grashoff. Der zu messende Kraftbereich ist jetzt auch enger eingrenzbar, das Verfahren erlaubt präzise Messungen in einem Bereich von drei bis fünf Pikonewton. „Wie bei Entwickung von neuen Mikroskopen versuchen auch wir immer bessere Auflösungen zu erreichen, was uns hier gelungen ist“, so Grashoff weiter.
Aufgrund der universellen Wechselwirkung von Kräften in Zellen könnte der neue Sensor in vielen Bereichen von Bedeutung sein. „Zentrale Fragestellungen ergeben sich in der Krebsforschung, denn hier ist schon länger bekannt, dass Tumorzellen in starren Geweben Vorteile haben. Auch für das Verständnis von Muskel- oder Hauterkrankungen könnten die Sensoren neue Einblicke in die Krankheitsmechanismen geben“, schaut Grashoff in die Zukunft.
Originalveröffentlichung
P. Ringer, A. Weiβl, A.-L. Cost, A. Freikamp, B. Sabass, A. Mehlich, M. Tramier, M. Rief and C. Grashoff; “Multiplexing molecular tension sensors reveals piconewton force gradient across talin-1”; Nature Methods; September 2017
Meistgelesene News
Originalveröffentlichung
P. Ringer, A. Weiβl, A.-L. Cost, A. Freikamp, B. Sabass, A. Mehlich, M. Tramier, M. Rief and C. Grashoff; “Multiplexing molecular tension sensors reveals piconewton force gradient across talin-1”; Nature Methods; September 2017
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Octet SF3 von Sartorius
Molekulare Bindungskinetik und Affinität mit einer einzigen dynamischen SPR-Injektion
Die Kurvenkrümmung ist der Schlüssel akkurater biomolekularer Wechselwirkungsanalyse

Octet RH16 and RH96 von Sartorius
Effiziente Proteinanalyse im Hochdurchsatz zur Prozessoptimierung und Herstellungskontrolle
Markierungsfreie Protein-Quantifizierung und Charakterisierung von Protein-Protein Wechselwirkungen

Octet R2 / Octet R4 / Octet R8 von Sartorius
Vollgas auf 2, 4 oder 8 Kanälen: Molekulare Wechselwirkungen markierungsfrei in Echtzeit analysieren
Innovative markierungsfreie Echtzeit-Quantifizierung, Bindungskinetik und schnelle Screening-Assays

Holen Sie sich die Analytik- und Labortechnik-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.