Labor im Beutel
Stammzellen kostengünstig, schnell und steril kultivieren, differenzieren und einfrieren
Humane Stammzellen gelten als Hoffnungsträger der Medizin – in Zukunft sollen sie die Therapie von vielen Leiden wie etwa neurodegenerativen Erkrankungen ermöglichen. Mit LabBag® haben Fraunhofer-Forscher ein All-in-One-System in Form eines transparenten Beutels entwickelt, in dem sich Stammzellen kostengünstig, schnell und steril kultivieren, differenzieren und einfrieren lassen. Die hergestellten Zellmodelle lassen sich für Toxizitätstests und die Entwicklung von Medikamenten nutzen.

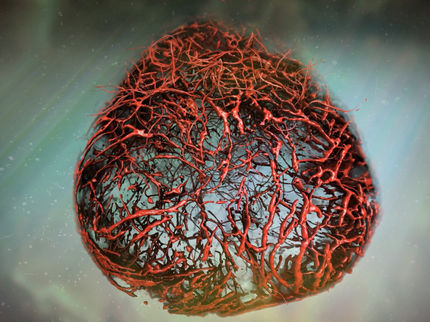
In den hängenden Tropfen können sich die dreidimensionalen Zellmodelle bilden.
© Foto Fraunhofer IST

Das Mini-Labor ist 150 mm lang, 120 mm breit und 20 mm hoch. Der Schraubverschluss wird per 3D-Druck hergestellt. An der oberen Beutelinnenseite sind die hydrophilen Spots erkennbar.
© Foto Fraunhofer IST


Weltweit suchen Wissenschaftler nach Wegen, Krankheiten mit Stammzellen zu heilen. Diese bieten das Potenzial, neuartige Wirkstoffe und Medikamente zu entwickeln. Stammzellmaterial bildet auch die Grundlage, wenn es darum geht, Krankheiten derart zu erforschen, wie es bisher nicht möglich war. Um aussagekräftige und übertragbare Forschungsergebnisse zu erzielen, muss das zu untersuchende Zellmaterial vermehrt werden. Außerdem zeigen neueste Untersuchungen, dass dreidimensionale Zellmodelle die Bedingungen im menschlichen Körper viel besser wiederspiegeln. Die Erzeugung dieser Zellaggregate erfolgt vor allem unter sterilen Bedingungen in tropfenförmigen Nährlösungen. Künftig lässt sich dieser Prozess kostengünstig und sicher realisieren: Im Projekt LabBag® haben die Fraunhofer-Institute für Biomedizinische Technik IBMT, für Schicht- und Oberflächentechnik IST und für Verfahrenstechnik und Verpackung IVV ihre Kompetenzen gebündelt und ein Minilabor in Form eines Kunststoffbeutels entwickelt, in dem sich humane induziert Pluripotente Stammzellen, also künstlich hergestellte Stammzellen, in einer sterilen Umgebung sowohl kultivieren als auch zu 3D-Aggregaten formen lassen. Diese können als patienten- oder krankheitsspezifische Testsysteme für die Medikamentenentwicklung und Wirkstoffforschung der Pharmaindustrie verwendet werden.
Schnelle Bildung von hängenden Tropfen ohne manuelles Pipettieren
Bislang werden Zellaggregate aus Stammzellen mit Hilfe von Pipettierrobotern, deren Anschaffung und Wartung kostspielig ist, oder durch manuelles Pipettieren erzeugt,was mit einem hohen Arbeits- und Zeitaufwand verbunden ist. Das manuelle Pipettieren in Petrischalen erfordert viel Übung, hinzu kommt die Gefahr der Kontamination.
Das »Labor im Beutel« der Fraunhofer-Forscher soll die Labor- und Sachkosten verringern, aber auch die Zellausbeute und die Prozesssicherheit deutlich steigern. Innerhalb weniger Sekunden lassen sich durch einfaches Schütteln des transparenten Beutels mehrere hundert hängende Tropfen erzeugen, die die Funktion von Mini-Bioreaktoren übernehmen. Die Nährlösungstropfen entwickeln sich quasi selbstständig als hängende Tropfen, in denen sich die Zellaggregate ausbilden können.
Zunächst wird die Nährlösung mit den Stammzellen in den Beutel eingefüllt. Dieser wird einmal umgedreht und dann wieder in die Ausgangslage gebracht. Bei diesem Vorgang bleiben die Tropfen an hydrophilen runden Spots hängen. Die Zellen sinken in die Rundung der Tropfen, wo sie sich miteinander verbinden und zu einem definierten 3D-Aggregat verschmelzen. »Wir haben die Beutelwand aus Polymerfolie zweifach beschichtet. Eine hydrophobe, wasserabweisende Grundschicht sorgt dafür, dass die proteinhaltige Nährlösung über die Fläche fließt und nicht anhaftet. Die 150 hydrophilen Spots mit jeweils einem Durchmesser von fünf Millimetern hingegen bewirken, dass die Tropfen hängen bleiben. Durch diese zweite Beschichtung in Form von runden Spots werden also die Tropfen ausgebildet«, erläutert Dr. Michael Thomas, Projektleiter und Wissenschaftler am Fraunhofer IST, dessen Team im Projekt für die Beschichtung der Folien zuständig ist. Um die Folienoberfläche derart gezielt funktionalisieren zu können, verwenden die Braunschweiger Forscher Atmosphärendruck-Plasmaverfahren. Bei dieser Technologie wird in einem Gasspalt zwischen zwei Elektroden durch Anlegen einer Wechselspannung ein physikalisches Plasma erzeugt, mit dem sich die Oberflächen unterschiedlichster Materialien behandeln lassen.
Der Clou: Die entstandenen Zellmodelle lassen sich sogar im Beutel einfrieren. Anders als beim manuellen Pipettieren entfällt das Umfüllen in ein separates Kryogefäß. Das Optimieren der Kryokonservierung, also das Einfrieren der Zellen, fällt in den Aufgabenbereich des Fraunhofer IBMT. Darüber hinaus ist das Institut im Projekt für die Kultivierung der Stammzellen sowie für die Charakterisierung und Analyse der dreidimensionalen Aggregate verantwortlich. »Wir fokussieren uns auf das Kultivieren von induziert Pluripotenten Stammzellen (iPS), da diese das Potenzial haben, sich zu jedem Zelltyp des Körpers und in jegliches Gewebe oder in bestimmte Gewebetypen zu entwickeln. Auch lösen sie – im Gegensatz zu embryonalen Zellen – keine ethischen Kontroversen aus«, sagt Dr. Julia Neubauer, Biologin am Fraunhofer IBMT. Die Stammzellen werden in ihrer Gestalt und ihren Fähigkeiten für bestimmte Aufgaben spezialisiert, was die Entwicklung von patientenspezifischen Medikamenten ermöglicht. Dr. Neubauer und ihre Kollegen konzentrierten sich auf die Differenzierung von Herzmuskelzellen, das heißt, sie haben die iPS-Zellen erfolgreich in diese Art von Zellen ausdifferenziert.
Hochwertige 3D-Zellmodelle wachsen innerhalb von 72 Stunden
Jeder Tropfen hat ein Volumen von ungefähr 20 Mikrolitern, die Größe des dreidimensionalen Zellmodells beträgt etwa 400 Mikrometer. Durch Variieren des Spotdurchmessers auf der Beuteloberfläche lässt sich die Aggregatgröße einstellen, um so gezielt das biologische Portfolio zu erweitern. Derzeit benötigen die Forscherin und ihr Team für die Herstellung der Aggregate im hängenden Tropfen etwa 72 Stunden. »Wir bezeichnen unseren LabBag®-Beutel als Mini-GMP-Labor (GMP, kurz für Good Manufacturing Practice). Er erfüllt alle Anforderungen an eine gute Herstellungspraxis. Da es sich um ein geschlossenes, steriles System handelt, fällt die Kontaminationsgefahr sehr gering aus. Letztendlich können wir bessere Zellmodelle für die Medikamentenforschung erzeugen, insofern lassen sich auch Tierversuche vermeiden«, betont die Forscherin. Geplant ist, Sensoren zur Prozessüberwachung zu integrieren.
Für die Beutelherstellung waren das Fraunhofer IVV in Freising und dessen Außenstelle in Dresden zuständig. Die Auswahl und Entwicklung des Materials einschließlich des Verschlusses und die Entwicklung des Beutel- sowie des Technologiekonzepts lag in ihrer Hand. »Wir haben uns nach zahlreichen Tests, etwa zur Dichtigkeit, zur Mikroskopierbarkeit, zur Biokompabilität sowie zur Temperatur- und Chemikalienbeständigkeit für Polymerfolien entschieden. Zuvor wurden 15 Polymergruppen identifiziert, von denen wir acht untersucht haben«, sagt Dr. Cornelia Stramm, Wissenschaftlerin am Fraunhofer IVV in Freising. »Das Anforderungsprofil an das Beutelsystem war sehr anspruchsvoll«, erklärt Andrea Liebmann vom Fraunhofer IVV Dresden. »Der LabBag® sollte eine hohe Transparenz und ausreichende Formbeständigkeit aufweisen, siegelbar, sterilisierbar, kryobeständig und stapelbar sein sowie eine einhändige Bedienbarkeit (selbstöffnend) und gute Zugänglichkeit für den Nährmedientausch bieten. Um diesen hohen Anforderungen gerecht zu werden, wurde ein teilautomatisierter Versuchsstand zur Herstellung der Beutel entwickelt.« Da der LabBag® sich günstig produzieren lässt, stellt er eine attraktive Alternative zu den herkömmlichen Ansätzen dar.
Das Mini-GMP-Labor bietet der Pharmaindustrie, aber auch kleineren Laboren ohne Reinraumtechnik die Möglichkeit, ohne hohe Investitionskosten qualitativ hochwertige Zellmodelle für die Medikamentenforschung zu kultivieren.