Das richtige Ziel identifizieren
Von der Proteinstruktur zur Behandlung der zystischen Fibrose
Biochemiker der UZH haben mit Hilfe der Kryo-Elektronenmikroskopie die detaillierte Architektur des Chloridkanals TMEM16A ermittelt. Dieses Protein gilt als aussichtsreiches Ziel, um wirksame Medikamente zur Behandlung der zystischen Fibrose zu entwickeln.
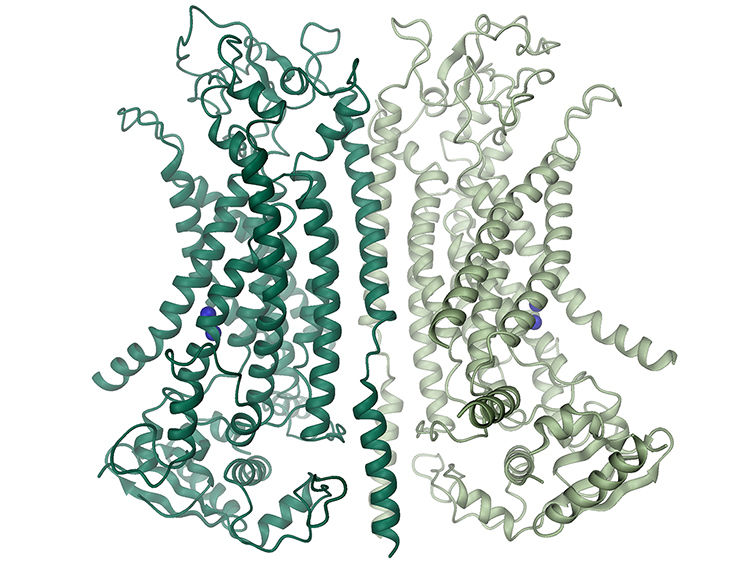
Modell des Chloridkanals TMEM16A: Die Kenntnisse über Struktur und Funktionsweise ebnen den Weg, um Medikamente gegen die zystische Fibrose zu entwickeln.
Raimund Dutzler, UZH
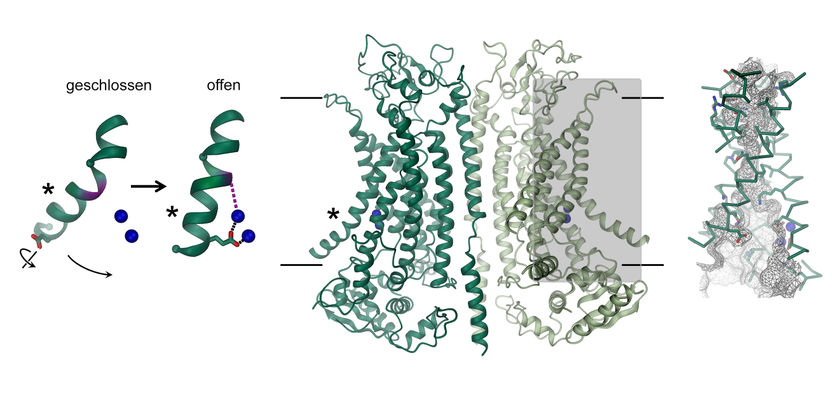
Struktur des Kalzium-aktivierten Chloridkanals TMEM16A. Der aus zwei gleichen Untereinheiten bestehende Kanal ist in der Mitte als Schleifenmodell gezeigt. Die Position der Membran ist durch Linien angedeutet. Die Pore einer Untereinheit (graues Rechteck) ist im Bild rechts detailliert dargestellt. Die Darstellung links zeigt die Änderung in der Struktur einer α-Helix (*) die zur Kanalöffnung führt. Gebundene Kalziumionen werden als blaue Kugeln gezeigt.
Raimund Dutzler, UZH
Die zystische Fibrose ist eine schwere Erbkrankheit der Lunge, für die es bisher noch keine Heilung gibt. Die Ursache der Krankheit ist eine Fehlfunktion des Chloridkanals CFTR. Diese verhindert in bestimmten Körperzellen die Sekretion von Chlorid, was die Schleimschicht in der Lunge austrocknet. Ein vielversprechender Therapieansatz beruht darin, einen alternativen Ionentransporter – den Kalzium-aktivierten Chloridkanal TMEM16A – zu aktivieren. Dieser befindet sich im selben Gewebe und könnte den Wasseraustausch von den Zellen zur Schleimschicht wiederherstellen. TMEM16A gehört zu einer Proteinfamilie, deren Mitglieder entweder als Ionenkanäle negativ geladene Chloridionen oder als Skramblasen Membranlipide durch die Zellmembran schleusen.
Struktur des Chloridkanals aufgeklärt
Bekannt aus früheren Arbeiten war bisher erst die Struktur einer TMEM16-Skramblase, die als Lipidtransporter eine wichtige Rolle bei der Blutgerinnung spielt. Nun haben Forschende am Biochemischen Institut erstmals die Architektur des Chloridkanals TMEM16A entschlüsselt. Das Team unter der Leitung von UZH-Professor Raimund Dutzler verwendete dazu die Kryo-Elektronenmikroskopie (Kryo-EM). Die Entwickler dieser Technologie, mit der sich die Struktur von Proteinen detailliert aufklären lässt, wurden kürzlich mit dem Chemie-Nobelpreis 2017 ausgezeichnet. «Der molekulare Aufbau des Membranproteins ist für die gezielte Entwicklung von Medikamenten zur Behandlung der zystischen Fibrose von grosser Bedeutung», betont Dutzler.
Neuer Aktivierungsmechanismus entdeckt
Der Chloridkanal TMEM16A kommt in verschiedenen Organen des Körpers vor und spielt eine wichtige Rolle bei der Sekretion von Chlorid in der Lunge, der Kontraktion der glatten Muskulatur und der Schmerzwahrnehmung. Wie sich dessen Struktur von eng verwandten Mitgliedern der TMEM16-Familie unterscheidet, und wie er durch die Bindung von Kalzium aktiviert wird, konnte nun mit Hilfe von Kryo-EM und elektrophysiologischen Methoden ermittelt werden. Während die generelle Architektur des Kanals den Skramblasen ähnlich ist, gibt es ausgeprägte Unterschiede in der Porenregion, die sich in beiden Untereinheiten des Proteins befindet. Skramblasen haben an dieser Stelle eine der Membran zugewandte polare Furche, an der die geladenen Kopfgruppen der Lipide durch die Membran geschleust werden. Im Gegensatz dazu bildet die selbe Region in TMEM16A einen vom Protein umschlossenen sanduhrförmigen Kanal, der in Abwesenheit von Kalzium geschlossen ist. Die Bindung von positiv geladenen Kalziumionen in unmittelbarer Nähe öffnet den Kanal und erlaubt negativ geladenen Chloridionen durch die Membran zu fliessen. «Dieser Aktivierungsmechanismus ist einzigartig, da die gebundenen Kalziumionen direkt die Struktur und Elektrostatik des Kanals beeinflussen», erklärt Erstautorin Cristina Paulino.
Grundlage für neue Therapien
Die Resultate über die Struktur und das Funktionieren von TMEM16A bilden die Basis für das Verständnis dieser wichtigen Proteinklasse und ebnen einen vielversprechenden Weg für die Entwicklung von Medikamenten gegen die zystische Fibrose. «Falls zukünftig Substanzen gefunden werden, die zur Aktivierung des Kanals führen, könnte TMEM16A den Defekt in der Chloridsekretion im Lungengewebe beheben», sagt Raimund Dutzler.