"Stop and Go" im Nervensystem
Max-Planck-Wissenschaftler entdecken, wie autoimmune T-Lymphozyten das Gehirn attackieren
Wissenschaftler des Max-Planck-Instituts für Neurobiologie erforschen Krankheitsmechanismen der Multiplen Sklerose, eine der häufigsten Autoimmunerkrankungen des Menschen. Bei dieser Erkrankung spielt die Invasion autoaggressiver T-Zellen in das Nervensystem eine entscheidende Rolle. Im Tiermodell der Multiplen Sklerose konnten die Neuroimmunologen jetzt das Verhalten dieser autoaggressiven T-Zellen im lebenden Hirngewebe mittels modernster Mikroskopieverfahren live verfolgen und charakterisieren.
Die Multiple Sklerose (MS) ist hierzulande die maßgeblichste entzündliche Erkrankung des Zentralnervensystems (ZNS). Sie ist gefürchtet wegen ihrer zahlreichen und vielfältigen neurologischen Ausfälle, wie z.B. Lähmungen, Gefühls- und Gleichgewichtsstörungen. Verursacht werden diese Schäden nach derzeitigem Stand der Forschung durch zahlreiche, im Gehirn und Rückenmark verstreute Entzündungsherde. T-Lymphozyten, die darauf spezialisiert sind, die körpereigene Hirnsubstanz zu attackieren und zu zerstören, machen einen wesentlichen Teil der Entzündungszellen in diesen Herden aus. Allerdings ist nicht geklärt, wie diese autoaggressiven Zellen in das Hirngewebe gelangen. Das Gehirn nimmt nämlich aus immunologischer Sicht eine Sonderstellung ein: T-Zellen, die durch die anderen Körpergewebe streifen, um Eindringlinge aufzuspüren, haben keinen freien Zutritt in das Nervensystem. Die Frage, wie sich autoaggressive T-Zellen Zutritt zum Gehirn verschaffen, ist anhand menschlichen Hirngewebes nicht zu beantworten, wohl aber durch Studien in Tiermodellen.
Die experimentelle autoimmune Enzephalomyelitis (EAE) bietet sich als besonders geeignetes Modell für autoaggressive Hirnentzündungen an, da sie nicht durch von außen eindringende Mikroben ausgelöst wird, sondern von körpereigenen autoimmunen T-Zellen. Die Übertragung dieser Zellen in gesunde Empfängertiere führt zu Entzündungsherden, die denen der Multiplen Sklerose stark ähneln. Die Forscher in Martinsried haben ein Verfahren entwickelt, um krankheitserzeugende autoaggressive T-Zellen durch Genmanipulation so zu verändern, dass sie sichtbar werden - sie fluoreszieren. In ein gesundes Empfängertier übertragen, können sie aufgrund ihrer Eigenfluoreszenz zu jedem Zeitpunkt in jedem Gewebe nachgewiesen werden.
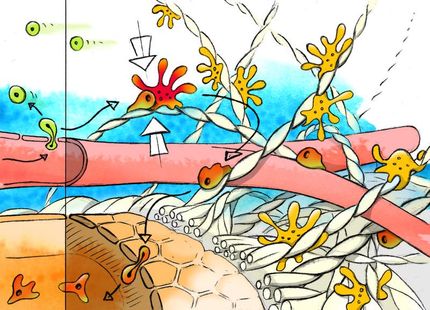
Die ersten Studien dieser fluoreszierenden T-Zellen zeigten, dass autoaggressive T-Zellen keineswegs - wie erwartet - direkt nach ihrer Übertragung in das Hirngewebe eindringen. Tatsächlich wandern sie auf einer komplizierten, streng vorgegebenen Route über mehrere Tage durch die peripheren Immunorgane (Lymphknoten, Milz) und erwerben auf diesem Weg die Fähigkeit, in das Zentrale Nervensystem einzudringen. Erst danach öffnen sich die Schleusen des Gehirns: Innerhalb von Stunden strömen Millionen autoaggressiver T-Zellen aus der Peripherie in das ZNS ein. Zeitgleich mit dieser Flut von Zellen kommt es zum Auftreten schwerer Lähmungen.
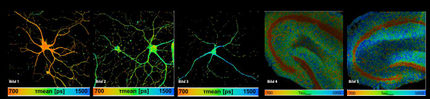
Um die Bewegung der autoaggressiven T-Zellen in das Gehirn und innerhalb des Hirngewebes in Echtzeit zu verfolgen, setzten die Martinsrieder Neurobiologen modernste optische Verfahren (Zwei-Photonen-Mikroskopie) ein und stellten dabei fest, dass autoaggressive T-Zellen im Hirngewebe zwei grundlegend verschiedenen Bewegungsmustern folgen: Die Mehrheit der Zellen bewegt sich mit einem für wandernde Zellen enormen Tempo von bis zu 25 Mikrometern pro Minute durch das Gewebe. Dieses Tempo ist um so bemerkenswerter, als das Nervengewebe ein vergleichsweise festes und kompaktes Gewebe darstellt. Die schnell wandernden T-Zellen durchziehen das Nervengewebe offenbar völlig ungerichtet und scheinen keinem Lockstoffgradienten, so genannten Chemokinen, zu folgen. Die Bewegung erfolgt in Wellen, d.h. die Zellen durchlaufen Phasen schneller Bewegungsaktivität, abgelöst von Phasen eines relativen Stillstands.
Eine kleinere Gruppe von T-Zellen scheint jedoch dauerhaft an Ort und Stelle zu verharren. Sie sind an einem Pol der Zellmembran fixiert, um den herum die Zellkörper heftig schwingen. Diese angedockten T-Zellen bilden spezialisierte Verbindungen, die aufgrund ihrer geordneten Struktur analog zu Nervenzellkontakten im Gehirn als immunologische "Synapsen" bezeichnet werden. Diese "Synapsen" befinden sich genau an den Fixpunkten der T-Zellen und bestehen aus dem zentral angeordneten T-Zellrezeptor, umgeben von Ankermolekülen, so genannten "Integrinen". Die Antigen-Erkennung von T-Zellen erfolgt über die Synapsen und manifestiert sich in der Freisetzung von Entzündungsstoffen, so genannten Cytokinen. Die zwei Bewegungsmuster der autoaggressiven T-Zellen im Gehirn legen folgende Interpretationen nahe: Die schnell durch die Hirnsubstanz kreuzenden autoaggressiven T-Zellen sind "auf der Suche" nach Zellen, die ihr passendes Antigen präsentieren. Die angedockten T-Zellen haben dagegen ihr Ziel erreicht und befinden sich im Prozeß der Antigen-Erkennung.
Obwohl es gesichert ist, dass in der autoimmunen Enzephalomyelitis die autoaggressiven T-Zellen für die Schäden im Gehirn verantwortlich sind, sind die Mechanismen, die diese Veränderungen verursachen, weitgehend unklar. "Unsere neugewonnenen Beobachtungen können zur Beantwortung dieser wichtigen Frage beitragen", sagt Alexander Flügel. Sowohl die beweglichen, als auch die angedockten autoaggressiven T-Zellen könnten auf unterschiedliche Weise Schaden anrichten: Die beweglichen Zellen dadurch, dass sie sich durch die Hirnsubstanz bohren, dabei Nervenbahnen und Hirnzellen verdrängen oder gar zerstören. Die arretierten T-Zellen durch ihre Immunsynapsen. Millionen dieser Synapsen bedeuten eine maximale Aktivierung von Millionen T-Zellen und somit eine Flut von Cytokinen im Gehirn. Die Cytokine beeinträchtigen jedoch die Integrität des Nervensystems, da sie das fein regulierte ZNS-Milieu durch Öffnung der schützenden Bluthirnschranke stören und damit die Weiterleitung von Nervenimpulsen blockieren sowie andere potenziell schädigende Immunzellen anlocken.
Auf die Frage, welche therapeutischen Konsequenzen sich aus diesen Befunden ableiten lassen, erklärt Hartmut Wekerle: "Eine Blockade der T-Zellwanderung und der Antigen-Erkennung im Gehirn sollte diese schädigenden Prozesse aufhalten helfen. Somit tragen diese ersten Echtzeit-Filmaufnahmen der Fortbewegung von Immunzellen im zentralen Nervensystem nicht nur zum Verständnis der Krankheitsmechanismen der Multiplen Sklerose und anderer Organ-spezifischer Autoimmunerkrankungen bei, sondern sie eröffnen möglicherweise auch neue therapeutische Ansätze."
Originalveröffentlichung: N. Kawakami, U.V. Nägerl, F. Odoardi, T. Bonhoeffer, H. Wekerle, A. Flügel; "Live imaging of effector cell trafficking and autoantigen recognition within the unfolding autoimmune encephalomyelitis lesion."; Journal of Experimental Medicine 2005, 201, 1805-1814