Ras-Katalyse - Der Film
Ansatz für molekulare Therapien bei Krebs
Bei vielen Tumoren ist das onkogene Ras-Protein dauerhaft "angeschaltet", so dass die Zellen unkontrolliert wachsen. Wie die Abschaltung des Ras-Proteins im Detail funktioniert, haben jetzt Biophysiker der Ruhr-Universität Bochum zusammen mit Wissenschaftlern des Max-Planck-Instituts in Dortmund mit einem ultra-sensitiven spektroskopischen Ansatz herausgefunden. Ein Verständnis des molekularen Mechanismus des Ras-Proteins liefert die Voraussetzung für die Entwicklung molekularer Therapien bei Krebserkrankungen.
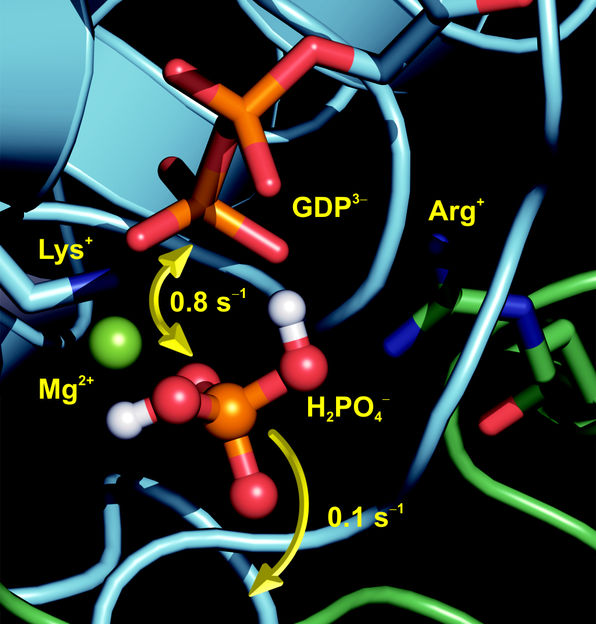
Das Ras-Protein ist der Schalter für das Zellwachstum: Wird es durch bestimmte Mutationen verändert (onkogen), dann steht der Schalter für das Zellwachstum dauerhaft auf "an" und die Zelle wächst unkontrolliert. Onkogenes Ras findet man in 25 Prozent aller menschlichen Tumore. "Um das unkontrollierte Wachstum zu stoppen, muss also der Abschaltprozess des Ras-Proteins genau verstanden werden", erklärt Prof. Gerwert. Abgeschaltet wird das Ras durch die Katalyse des Triphosphats GTP zu Diphosphat GDP. Den molekularen Abschaltmechanismus haben die RUB-Biophysiker um Dr. Carsten Kötting und Prof. Klaus Gerwert in Zusammenarbeit den Professoren Roger Goody und Alfred Wittinghofer vom Max Planck-Institut für molekulare Physiologie herausgefunden.
Die jetzt veröffentlichte spektroskopische Arbeit ergänzt die früheren Arbeiten der Dortmunder Wissenschaftler, die bereits die Raumstrukturen des Ras-Proteins und seinem Interaktionspartner, dem GAP, aufgeklärt haben. Mit der trFTIR-Technik (time-resolved Fourier Transform Infrared) der Bochumer Biophysik konnten die Forscher jetzt den enzymatischen Weg der durch das Protein GAP katalysierten GTPase-Reaktion des Ras-Proteins wie in einem Film beobachten. Dabei konnten sie ein bisher nicht charakterisiertes, proteingebundenes Phosphat mit nur Millisekunden Lebenszeit identifizieren, seine Position im Protein und seinen Protonierungszustand bestimmen. "Bislang war bekannt, dass im 'an'-Zustand das Triphosphat GTP an das Protein gebunden ist und im 'aus'-Zustand das Diphosphat GDP", erklärt Prof. Gerwert. "Jetzt konnten wir mit der trFTIR beobachten, dass der Schalter in dieser neu entdeckten Zwischenstufe leicht wieder in den 'an'-Zustand 'zurückschnappen' kann." Die daran beteiligten Protonen sind entscheidend für den Reaktionsmechanismus. Die Forscher vermuten, dass eine solche Zwischenstufe auch in anderen GTPasen und ATPasen eine wichtige Rolle spielt.
Die Entdeckungen über das Ras-Protein könnten für zukünftige Krebsmedikamente von Bedeutung sein: Mit dem erworbenen Wissen kann man jetzt versuchen, mit maßgeschneiderten Substanzen das onkogene Ras in den "aus"-Zustand zu zwingen, indem man das "Zurückschnappen" verhindert. Im "an"-Zustand interagiert das Ras mit der Raf-Kinase. Kürzlich hat Bayer für eine maßgeschneiderte molekulare Therapie ein Medikament entwickelt, das als so genannter Raf-Kinase-Hemmer bei Nierenkrebs erfolgreich eingesetzt wird.
Originalveröffentlichung: C. Kötting, M. Blessenohl, Y. Suveyzdis, R. S. Goody, A. Wittinghofer, K. Gerwert; "A phosphoryl transfer intermediate in the GTPase-reaction of Ras in complex with its GTPase-activating protein"; Proc. Natl. Acad. Sci. USA 2006, 103 (38), 13911-13916.
Meistgelesene News
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Kjel- / Dist Line von Büchi
Kjel- und Dist Line - Wasserdampfdestillation und Kjeldahl-Anwendungen
Maximale Genauigkeit und Leistung für Wasserdampfdestillation und Kjeldahl-Anwendungen

AZURA Purifier + LH 2.1 von KNAUER
Präparative Flüssigkeitschromatografie - Neue Plattform für mehr Durchsatz
Damit sparen Sie Zeit und verbessern die Reproduzierbarkeit beim Aufreinigen

Holen Sie sich die Analytik- und Labortechnik-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.