Ras-GAP Katalyse Schritt für Schritt aufgeklärt
Die Rolle der Wassermoleküle wurde bisher unterschätzt
Wachstumsprozesse in lebenden Zellen werden durch die Interaktion des Proteins Ras mit dem GAP-Protein gesteuert - Störungen in diesem Regelprozess etwa durch Mutationen im Ras-Protein können zur Entstehung von Krebs beitragen. Die Bochumer Proteinforscher Prof. Dr. Klaus Gerwert und Dr. Carsten Kötting (Lehrstuhl für Biophysik der RUB) haben nun in Zusammenarbeit mit Prof. Dr. Alfred Wittinghofer (Max-Planck-Institut für Molekulare Physiologie, Dortmund) die katalytischen Schritte dieser Protein-Protein-Interaktion zwischen Ras und GAP im Detail aufgelöst. Sie entdeckten dabei auch die entscheidende Rolle proteingebundener Wassermoleküle.
In Krebszellen findet man veränderte Ras-Proteine. Diese onkogen mutierten Ras-Proteine können nicht mehr durch das GAP-Protein abgeschaltet werden, so dass die Wachstumsprozesse außer Kontrolle geraten. Die Zellen wachsen ungebremst und schließlich entsteht ein Tumor. Ein Verständnis des Abschaltmechanismus auf der atomaren Ebene ist eine wichtige Voraussetzung dafür, gezielt nach kleinen Molekülen forschen zu können, mit denen man die Störung des Abschaltens in so genannten molekularen Therapieansätzen beheben kann.
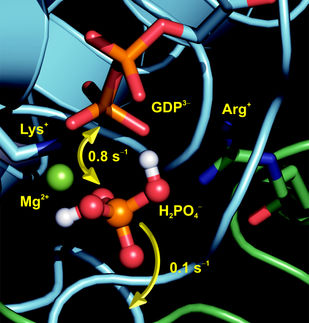
Nachdem der Konstruktionsplan für die Lebensprozesse, das Genom, entschlüsselt ist, wollen Forscher jetzt herausfinden, wie die einzelnen Bauteile in der lebenden Zelle miteinander interagieren. Bei vielen Prozessen innerhalb von Zellen finden sich so genannten G-Proteine, zu denen auch Ras gehört, als wichtige regulierende Module, die Prozesse an- und abschalten können. Dabei zeigt sich, dass beim Abschalten der G-Proteine der "Arginin-Finger" der herunter regulierenden GAP-Proteine eine katalytische Rolle spielt. Alfred Wittinghofer hat die wichtige Rolle des von ihm benannten "Arginin-Fingers" für die Ras-Katalyse entdeckt. Aufbauend auf seinen Arbeiten konnten Carsten Kötting und Klaus Gerwert jetzt die einzelnen Schritte dieser Interaktion auflösen. Insbesondere konnten sie die Bewegung des entscheidenden "Arginin-Fingers" direkt beobachten.
Messungen mit der zeitaufgelösten FTIR-Spektroskopie, trFTIR, zeigen, wie der positiv geladene "Arginin-Finger" in die negativ geladene GTP-Bindetasche des Ras-Proteins gezogen wird und dabei proteingebundene Wassermoleküle aus der engen Bindetasche drückt. Die Rolle der proteingebundenen und dann freigesetzten Wassermoleküle in einer Protein-Protein-Wechselwirkung konnte zum ersten Mal detailliert aufgeklärt werden und scheint auch für andere Protein-Protein-Wechselwirkungen exemplarisch zu sein, insbesondere bei der GTP- und ATP-Hydrolyse. "Dies ist ein wichtiger Schritt zu einem besseren Verständnis der Rolle der Wassermoleküle für die Protein-Proteinwechselwirkung", folgert Prof. Gerwert.
Die vibrationsspektroskopische Methode trFTIR war entscheidend für die Entdeckung. Prof. Gerwert konnte mit dieser mehrfach preisgekrönten und zuletzt mit dem Innovationspreis Ruhr gewürdigten Methode bereits die Reaktionsmechanismen von einigen Membran-Proteinen aufklären. Die aktuellen Arbeiten zeigen, dass auch Protein-Protein-Interaktionen räumlich und zeitlich mit höchstmöglicher Auflösung bestimmt und so das komplexe dynamische Wechselspiel der Proteine auf atomarer Ebene bestimmt werden können.
Originalveröffentlichung: Carsten Kötting, Angela Kallenbach, Yan Suveyzdis, Alfred Wittinghofer, and Klaus Gerwert: "The GAP arginine finger movement into the catalytic site of Ras increases the activation entropy."; PNAS 2008, vol. 105, Nr. 17, S. 6260-6265.
Diese Produkte könnten Sie interessieren
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!

Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!