„Zwei in eins“-Enzym: ungewöhnlich flexibel
RUB-Forscher haben die Struktur eines Virusproteins geklärt
Ein Virus, das das im Ozean lebende Cyanobakterium Prochlorococcus befällt, kann bestimmte Farbstoffe besser herstellen als sein Wirt. Anders als das Bakterium braucht es dazu nur ein Enzym, Prochlorococcus braucht zwei. Trick des Virus ist die Phycoerythrobilin Synthase, ein „Zwei in eins“-Enzym. Thorben Dammeyer hat im Rahmen seiner Doktorarbeit in der Arbeitsgruppe von Prof. Dr. Nicole Frankenberg-Dinkel in Kooperation mit Juniorprofessor Dr. Eckhard Hofmann die 3D-Struktur dieses Enzyms aufgeklärt. Entdeckt wurde eine überraschende Flexibilität: Verschiedene Bereiche des Proteins können unterschiedliche Positionen einnehmen - eine ungewöhnliche Eigenschaft für Proteine in Verbindung mit ihrem Substrat.
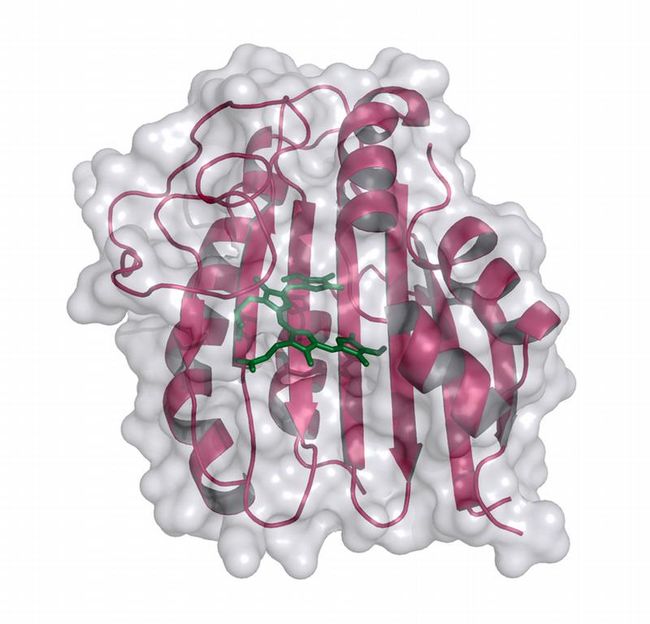
Dreidimensionales Strukturmodell der Phycoerythrobilin Synthase (PebS) mit gebundenem Substrat Biliverdin (grün).
Ruhr-Universität Bochum
Das Virus namens P-SSM2 mit dem „Zwei in eins“-Enzym befällt das Cyanobakterium Prochlorococcus, das unter den Cyanobakterien, die in Gewässern und Meeren in großer Menge vorkommen, eine Ausnahme darstellt: Anders als seine Artgenossen fängt es Licht für die Photosynthese nicht mittels roter und blauer Pigmente sondern wie höhere Pflanzen mittels Chlorophyll ein. Trotzdem verfügt Prochlorococcus über die Erbinformation für die komplette Maschinerie, um diese Pigmente herzustellen, und zwar in zwei Schritten mit zwei verschiedenen Enzymen als Katalysatoren.
„Die Tatsache, dass wir in dem Virus den genetischen Bauplan für ein Enzym gefunden haben, das das rote Pigment effizienter herstellen kann als sein Wirt, hat uns einerseits überzeugt, dass der Farbstoff für Prochlorococcus nicht unwichtig sein kann, selbst wenn es ihn zum Lichtfang nicht braucht“, erklärt Nicole Frankenberg-Dinkel. “Andererseits wollten wir natürlich wissen, wie es sein kann, dass ein Enzym zwei Funktionen übernimmt.“ Um das Enzym näher zu untersuchen, wandten die Forscher unter anderem die Röntgenstrukturanalyse an und betrachteten so die dreidimensionale Struktur des Enzyms hoch aufgelöst sowohl alleine als auch im Verbund mit seinem natürlichen Substrat, dem grünen Biliverdin IXa. Dabei konnten sie die sog. Bindetasche auflösen, in der das Substrat an das Enzym fixiert und in den roten Farbstoff umgewandelt wird. „Wir konnten sehen, dass verschiedene Bereiche des Enzyms um die Bindetasche herum in der Lage sind, unterschiedliche Positionen einzunehmen“, erklärt Frankenberg-Dinkel. „Diese Fähigkeit ist für Proteine in Lösung vielleicht nicht ungewöhnlich, aber sehr selten in Proteinkristallen zu finden.“ Die beobachteten Strukturvariationen geben den Forschern einen ersten Hinweis auf die Bewegung des Enzyms bei der Katalyse.
Nächster Schritt in der Erforschung des ungewöhnlich flexiblen Proteins werden Studien an gezielt und zufällig genetisch veränderten Formen sein. „Damit wollen wir die Evolution dieses besonderen Enzyms im Reagenzglas verfolgen“, erläutert Frankenberg-Dinkel.
Originalveröffentlichung: Dammeyer, T., Hofmann, E. & Frankenberg-Dinkel, N.; "Phycoerythrobilin synthase (PebS) of a marine virus. Crystal structure of the biliverdin-complex and the substrate free form"; J. Biol. Chem. 2008, 283, 27547-27554
Meistgelesene News
Themen
Organisationen
Weitere News aus dem Ressort Wissenschaft
Diese Produkte könnten Sie interessieren

Kjel- / Dist Line von Büchi
Kjel- und Dist Line - Wasserdampfdestillation und Kjeldahl-Anwendungen
Maximale Genauigkeit und Leistung für Wasserdampfdestillation und Kjeldahl-Anwendungen

AZURA Purifier + LH 2.1 von KNAUER
Präparative Flüssigkeitschromatografie - Neue Plattform für mehr Durchsatz
Damit sparen Sie Zeit und verbessern die Reproduzierbarkeit beim Aufreinigen

Holen Sie sich die Analytik- und Labortechnik-Branche in Ihren Posteingang
Mit dem Absenden des Formulars willigen Sie ein, dass Ihnen die LUMITOS AG den oder die oben ausgewählten Newsletter per E-Mail zusendet. Ihre Daten werden nicht an Dritte weitergegeben. Die Speicherung und Verarbeitung Ihrer Daten durch die LUMITOS AG erfolgt auf Basis unserer Datenschutzerklärung. LUMITOS darf Sie zum Zwecke der Werbung oder der Markt- und Meinungsforschung per E-Mail kontaktieren. Ihre Einwilligung können Sie jederzeit ohne Angabe von Gründen gegenüber der LUMITOS AG, Ernst-Augustin-Str. 2, 12489 Berlin oder per E-Mail unter widerruf@lumitos.com mit Wirkung für die Zukunft widerrufen. Zudem ist in jeder E-Mail ein Link zur Abbestellung des entsprechenden Newsletters enthalten.



























































