Neues Werkzeug in der GPCR-Forschung: CRISPR/Cas9 fusioniert Luciferase mit GPCRs für BRET-Assays
BMG LABTECH GmbH
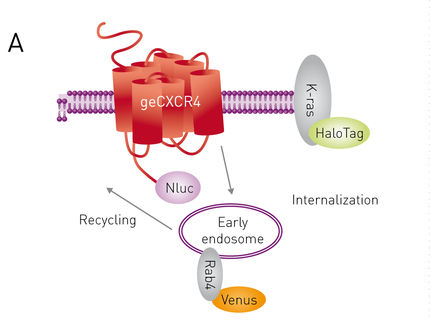
„Genschere“ erlaubt Analyse von Aktivierung und Translokation eines endogen exprimierten Rezeptors
G-protein gekoppelte Rezeptoren (GPCR) sind wichtige Ziele von Arzneimitteln. Daher werden Methoden benötigt um Rezeptor-Liganden-Interaktionen und Rezeptor-Internalisierung zu untersuchen. Der Transfer von Biolumineszenz auf benachbarte Fluorophore (Biolumineszenz-Resonanzenergietransfer – BRET) ist ein vielseitiges Werkzeug, um entsprechende Interaktionen zu untersuchen. Bislang ist diese Methode durch die ektopische Expression der Fluorophor- bzw. Luciferase-markierten Interaktionspartnern begrenzt. Die Editierung des Genoms mit CRISPR/Cas9 überwindet dieses Problem, indem die Luciferase mit einem der Interaktionspartner fusioniert wird und somit endogen exprimiert wird. CRISPR/Cas9 editierte Zellen, die endogen ein CXCR4/NanoLuc® Fusionsprotein exprimierten, wurden in Verbindung mit β-Arrestin/Venus verwendet, um die Rezeptoraktivierung zu überwachen. Durch die Verwendung zwei verschiedener Akzeptorfluorophore, die jeweils an einen Membran- oder Endosom-Marker gebunden waren, wurde die Überwachung der Rezeptorinternalisierung ermöglicht. Die neuartige CRISPR / Cas9-Technik fusionierte den NLuc-BRET-Donor erfolgreich mit endogen exprimiertem CXCR4. Die resultierenden Proteinmengen waren ausreichend, um die Rezeptorwechselwirkungen sowie die Internalisierung zu überwachen. Der Internalisierungstest beruht auf zwei Akzeptor-Fluorophoren, deren selektive Detektion durch den Monochromator des CLARIOstar Mikroplattenreader ermöglicht wurde.
Jetzt White Paper herunterladen
Neues Werkzeug in der GPCR-Forschung: CRISPR/Cas9 fusioniert Luciferase mit GPCRs für BRET-Assays
„Genschere“ erlaubt Analyse von Aktivierung und Translokation eines endogen exprimierten Rezeptors