Mikroorganismen bauen die besten kraftstoffsparenden Wasserstoffzellen
Bei allem Fortschritt, den die Technologie in unserem Leben gemacht hat, steht sie in vielen Fällen hinter dem, was die Natur tun kann. Ameisen können das 5.000-fache ihres Gewichts tragen, und Spinnennetze sind fünfmal stärker als Stahl. Die Kraftstoffeffizienz ist nicht anders. In einer neuen Studie, die in der Angewandte Chemie International Edition zu sehen ist, berichten Forscher des Nara Institute of Science and Technology (NAIST) über neue Details über den Protonentransferweg der Nickel-Eisen[NiFe]-Hydrogenase mittels Fourier-Transfer-Infrarotspektroskopie (FT-IR). Dieser Transfer ist entscheidend für den Wasserstoff-Stoffwechsel von Mikroorganismen, und die Studie gibt Wissenschaftlern ein besseres Verständnis dafür, wie sie die Natur beim Bau neuer Biokraftstoffzellen nachahmen können.
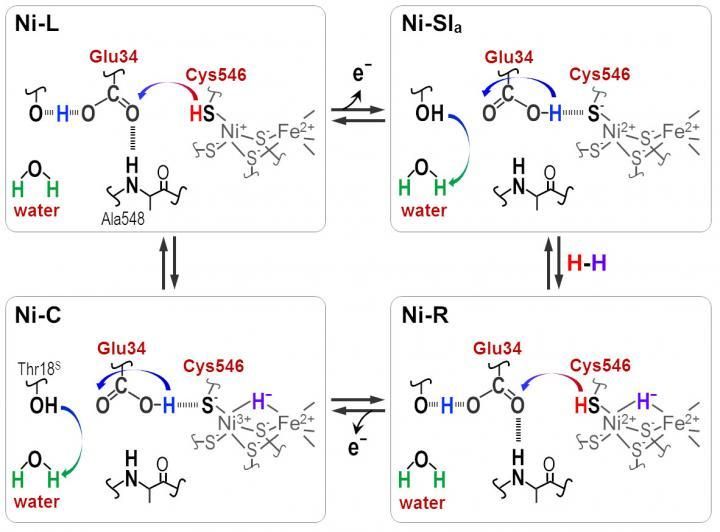
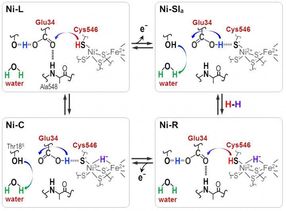
Protonen werden zwischen der aktiven NiFe-Stelle und dem Protein, das durch die Cyt546- und Glu34-Reste umgibt, während der katalytischen Reaktion der [NiFe]-Hydrogenase übertragen.
Shun Hirota
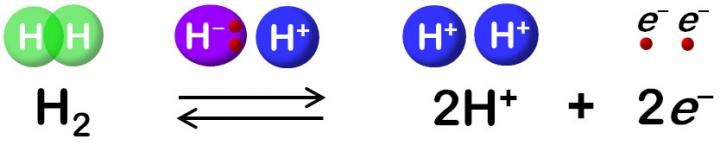
Hydrogenase katalysiert die reversible Oxidation von H2.
Shun Hirota
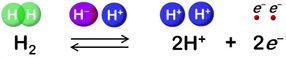
Der Wasserstoffstoffwechsel ist eine der ältesten Formen der Energiegewinnung für das Leben und eine der am intensivsten untersuchten wegen ihrer Bedeutung für die Evolution. Es hat auch Aufmerksamkeit erregt, da es sich um eine saubere Energiequelle handelt. Unter den Enzymen, die für den Wasserstoffstoffwechsel verantwortlich sind, ist die [NiFe]-Hydrogenase die am häufigsten vorkommende und älteste.
Über das Enzym ist viel bekannt. Es oxidiert Wasserstoffatome reversibel durch seine Ni-Fe-aktive Stelle, die von spezifischen Aminosäuren umgeben ist. Allerdings stellt NAIST Professor Shun Hirota, der die Studie geleitet hat, fest, dass bestimmte Grundlagen in den chemischen Reaktionen verstanden werden müssen, bevor diese Nanomaschine zur Entwicklung von Biokraftstofftechnologien eingesetzt wird.
"Hydrid und Proton koordinieren mit der Ni-Fe-Position im Protonierungsdeprotonierungszyklus, was zu vier Hydrogenasezuständen führt. Aber der Protonentransferweg bleibt unbekannt", sagt er.
Ein Grund für die mangelnde Klarheit war die Unfähigkeit, Dehnungsfrequenzen verschiedener Wasserstoffbindungen zu lösen. In der neuen Arbeit löste Hirotas Team in Zusammenarbeit mit anderen Forschern in Japan und China dieses Problem, indem es Fotokonvertierungen von drei Hydrogenasezuständen mit FT-IR-Spektren beobachtete.
Deutliche Absorptionsfrequenzen zeigten, dass eines der vier Cysteine, Cystein 546, zusammen mit einer weiteren Aminosäure, Glutaminsäure 34, und einem geordneten Wassermolekül für den Transfer entscheidend sind. Aus den neuen Informationen schlossen die Wissenschaftler, wie das Schwefelmolekül von Cystein 546 und die Säuregruppe in Glutaminsäure 34 Wasserstoffbindungen bilden, um den Wasserstofftransport zu regulieren.
"Unsere Ergebnisse zeigen, dass Cystein 546 ein Protonendonator und -akzeptor im Hydrogenasezyklus von [Ni-Fe] ist. Sie zeigen auch, wie eine Wasserstoffbindung mit niedriger Barriere für Glutaminsäure 34 während des katalytischen Zyklus gebildet und gespalten wird", sagt Hirota.
Mikroorganismen haben sich an ein breiteres Spektrum von Umweltbedingungen angepasst als der Mensch. Sie finden sich im angenehmen Klima unserer Schlafzimmer in den feindlichsten Umgebungen der Welt wieder. Wenn man also sieht, wie die [Ni-Fe]-Stätte der [Ni-Fe]-Hydrogenase Protonen optimal überträgt, ist das ein Paradigma für Forscher, die hocheffiziente Energiekatalysatoren unter einer Vielzahl von Bedingungen herstellen wollen.
"Das Leben hat Milliarden von Jahren damit verbracht, sich an die Energie anzupassen. Wir glauben, dass es uns das beste Modell für die Energieeffizienz der Zukunft bietet", sagt Hirota.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.
Originalveröffentlichung
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!

Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!
![[Fe]-Hydrogenase-Katalyse mittels Parawasserstoff-verstärkter Kernmagnetresonanzspektroskopie sichtbar gemacht](https://img.chemie.de/Portal/News/675fd46b9b54f_sBuG8s4sS.png?tr=w-712,h-534,cm-extract,x-0,y-16:n-zoom)
























































