Neue Methode zur Sequenzierung von Millionen Einzelzellen - einfacher und kostengünstiger
Effiziente Hochdurchsatz-Methode mit vielfachem Anwendungsbereich
Die RNA-Sequenzierung ist eine wichtige Technologie zur Erforschung von Zellen und von Krankheiten. WissenschafterInnen am CeMM Forschungszentrum für Molekulare Medizin der Österreichischen Akademie der Wissenschaften haben nun eine neue Methode entwickelt, um sehr viele Einzelzellen einfacher und kostengünstiger zu sequenzieren.

Die Studienautoren André F. Rendeiro, Paul Datlinger und Christoph Bock
Klaus Pichler, CeMM
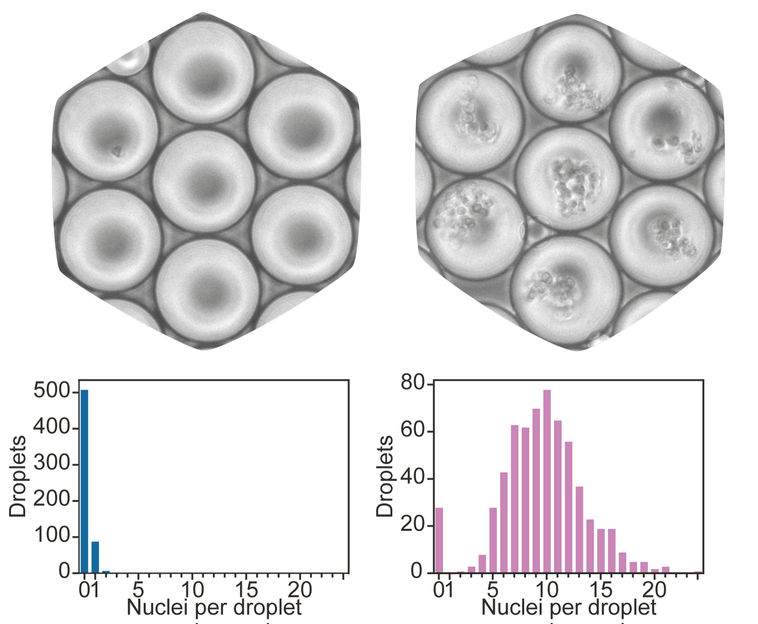
Emulsionströpfchen von einem scifi-RNA-seq Experiment, die mit einem Vielfachen an Zellen beladen wurden
Paul Datlinger, CeMM

Die RNA-Sequenzierung ist eine wichtige Technologie zur Erforschung von Zellen und von Krankheiten. Insbesondere die Einzelzell-Sequenzierung ermöglicht es, die Heterogenität und Vielfalt unseres Körpers aufzudecken. Sie ist die zentrale Technologie des „Human Cell Atlas“ bei der Kartierung aller Zellen des Menschen. Allerdings stößt die Methode bei sehr großen Projekten an ihre Grenzen, da sie zeitaufwändig und sehr teuer ist. Wissenschafter aus der Forschungsgruppe von Christoph Bock, Principal Investigator am CeMM Forschungszentrum für Molekulare Medizin der Österreichischen Akademie der Wissenschaften sowie Professor an der Medizinischen Universität Wien, haben eine neue Methode entwickelt, um sehr viele Einzelzellen einfacher und kostengünstiger zu sequenzieren. Die Studie wurde nun in Nature Methods publiziert.
Die Erforschung von Zellen ist eine wichtige Grundlage für die Entwicklung einer personalisierten Medizin. Vor fünf Jahren starteten Wissenschafter weltweit das Projekt „Human Cell Atlas“ mit dem Ziel, sämtliche Zellen im menschlichen Körper zu katalogisieren. Diese Daten haben zum Beispiel geholfen, sehr schnell diejenigen Zelltypen zu identifizieren, die das Coronavirus besonders gut infizieren kann.
Um die Erstellung solcher Zell-Kataloge zu beschleunigen und zu verbessern, entwickelten Paul Datlinger und André F. Rendeiro aus der Forschungsgruppe von Christoph Bock am CeMM eine Methode, um die Aktivität der Gene in sehr vielen Einzelzellen gleichzeitig auslesen zu können. Diese „scifi-RNA-seq“ (für: „single-cell combinatorial fluidic indexing“) genannte Methode markiert die RNA vieler Zellen vorab mit Barcodes, bevor die Zellen in einem Mikrofluidik-Chip aufgelöst und ihre RNA zur Einzelzell-Sequenzierung vorbereitet wird. Durch diese Barcodes wird ein wesentliches Problem bestehender Methoden zur Einzelzell-Sequenzierung überwunden.
Das bisher genutzte Verfahren steht vor der Herausforderung, dass Einzelzellsuspension nur in einer sehr niedrigen Konzentration in den Mikrofluidik-Chip geladen werden kann, um zu vermeiden, dass zwei Zellen im selben Emulsionströpfchen landen, wodurch ein verfälschtes Zellprofil entstehen würde. Der Großteil der Emulsionströpfchen muss daher leer bleiben, um Abstand zu den geladenen Tröpfen zu schaffen. Die Reagenzien werden also nur sehr ineffizient genutzt.
Durch die vorgeschaltete Markierung der Zellen mit diversen zusätzlichen Barcodes können die Emulsionstropfen bei scifi-RNA-seq mit vielen Zellen gleichzeitig beladen und trotzdem Einzelzellen analysiert werden. Dies spart Zeit und Kosten. Studienautor Paul Datlinger erklärt: „Auf dem populären 10x-Genomics-System messen wir mit dieser Methode 15-fach mehr Einzelzellen. Die zusätzlichen Barcodes erlauben es außerdem, tausende Proben zu markieren und in einer einzigen Mikrofluidik-Analyse zu prozessieren. So konnten wir im Rahmen unserer Studie einen CRISPR-Screen mit Einzelzell-Sequenzierung in menschlichen T-Zellen durchführen. In Zukunft soll unsere Methode unter anderem dabei helfen, Immuntherapien für die Behandlung von Krebs zu verbessern.“
Effiziente Hochdurchsatz-Methode mit vielfachem Anwendungsbereich
Von der neuen Methode profitieren besonders jene Projekte, die sehr viele Zellen oder sehr viele Proben mit Einzelzell-Sequenzierung analysieren wollen. Projektleiter Christoph Bock erklärt: „scifi-RNA-seq ermöglicht eine effiziente RNA-Sequenzierung von Millionen Einzelzellen und vereinfacht damit die Charakterisierung komplexer Gewebe, Organe und ganzer Organismen. Auch im biomedizinischen Bereich ist es oft wichtig, sehr viele Einzelzellen gleichzeitig zu analysieren, zum Beispiel zur Entdeckung seltener Stammzellpopulationen in Tumoren oder Krebszellen im Blut. Außerdem kann scifi-RNA-seq dazu beitragen, dass Wirkstoff-Screens und CRISPR-Screens zunehmend mit hochauflösender Einzelzell-Sequenzierung kombiniert werden.“























































