Schutzpanzer des Superkeims C.difficile enthüllt
Spektakuläre Kettenhemdstruktur könnte Erfolg von C.diff bei der Abwehr von Antibiotika und Molekülen des Immunsystems erklären
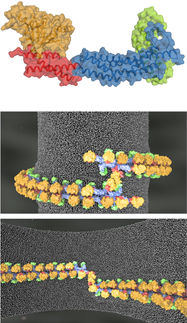
Die spektakuläre Struktur des Schutzpanzers des Superbazillus C.difficile wurde zum ersten Mal enthüllt und zeigt die engmaschige und doch flexible äußere Schicht - wie ein Kettenhemd.
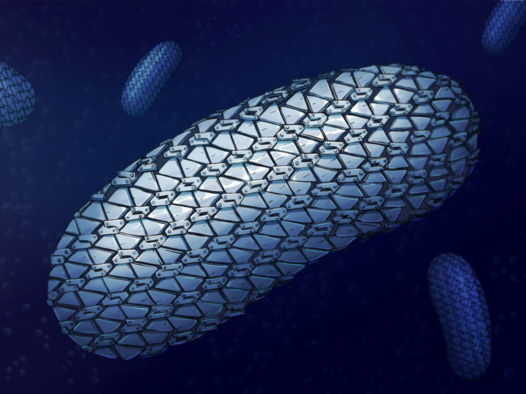
Die spektakuläre Struktur des Schutzpanzers des Superbazillus C.difficile wurde zum ersten Mal enthüllt und zeigt die engmaschige und doch flexible äußere Schicht - wie ein Kettenhemd. Dieser Aufbau verhindert das Eindringen von Molekülen und bietet ein neues Ziel für künftige Behandlungen, so die Wissenschaftler der Universitäten Newcastle, Sheffield und Glasgow, die diese Struktur aufgedeckt haben.
Newcastle University, UK
Dieser Aufbau verhindert, dass Moleküle eindringen, und bietet ein neues Ziel für künftige Behandlungen, so die Wissenschaftler, die diese Struktur aufgedeckt haben.
Das Team von Wissenschaftlern der Universitäten Newcastle, Sheffield und Glasgow sowie Kollegen vom Imperial College und der Diamond Light Source haben die Struktur des Hauptproteins SlpA, das die Glieder des Kettenpanzers bildet, in der Zeitschrift Nature Communications veröffentlicht und zeigen, wie sie so angeordnet sind, dass sie ein Muster bilden und diesen flexiblen Panzer erzeugen. Dies eröffnet die Möglichkeit, C. diff-spezifische Medikamente zu entwickeln, die die Schutzschicht durchbrechen und Löcher schaffen, durch die Moleküle eindringen und die Zelle abtöten können.
Schützende Panzerung
Eine der vielen Möglichkeiten, mit denen sich der Durchfall verursachende Superbazillus Clostridioides difficile vor Antibiotika schützt, ist eine spezielle Schicht, die die Zelle des gesamten Bakteriums bedeckt - die Oberflächenschicht oder S-Schicht. Dieser flexible Panzer schützt vor dem Eindringen von Medikamenten oder Molekülen, die von unserem Immunsystem zur Bekämpfung von Bakterien freigesetzt werden.
Das Team hat die Struktur der Proteine und ihre Anordnung mit einer Kombination aus Röntgen- und Elektronenkristallografie bestimmt.
Die korrespondierende Autorin Dr. Paula Salgado, Senior Lecturer in Macromolecular Crystallography, die die Forschung an der Newcastle University leitete, sagte: "Ich habe vor mehr als 10 Jahren mit der Arbeit an dieser Struktur begonnen. Es war ein langer, harter Weg, aber wir haben einige wirklich aufregende Ergebnisse erzielt! Überraschenderweise haben wir festgestellt, dass das Protein, das die äußere Schicht bildet, SlpA, sehr dicht gepackt ist und nur sehr schmale Öffnungen aufweist, durch die nur wenige Moleküle in die Zellen eindringen können. Die S-Schicht von anderen bisher untersuchten Bakterien hat in der Regel breitere Lücken, durch die größere Moleküle eindringen können. Dies könnte erklären, warum sich C.diff erfolgreich gegen Antibiotika und Moleküle des Immunsystems wehrt, die es angreifen sollen.
"Spannenderweise eröffnet dies auch die Möglichkeit, Medikamente zu entwickeln, die auf die Wechselwirkungen abzielen, aus denen das Kettenhemd besteht. Wenn wir diese unterbrechen, können wir Löcher schaffen, durch die Medikamente und Moleküle des Immunsystems in die Zelle eindringen und sie töten können.
Eine der aktuellen Herausforderungen in unserem Kampf gegen Infektionen ist die zunehmende Fähigkeit von Bakterien, den Antibiotika zu widerstehen, mit denen wir versuchen, sie zu töten. Die WHO hat die Antibiotikaresistenz oder allgemeiner die antimikrobielle Resistenz (AMR) zu einer der zehn größten globalen Bedrohungen für die öffentliche Gesundheit der Menschheit erklärt.
Verschiedene Bakterien haben unterschiedliche Mechanismen, um gegen Antibiotika resistent zu werden, und einige haben mehrere Möglichkeiten, deren Wirkung zu umgehen - die so genannten Superbugs. Zu diesen Superbugs gehört auch C. diff, ein Bakterium, das den menschlichen Darm infiziert und gegen alle bis auf drei gängige Medikamente resistent ist. Nicht nur das, es wird sogar zu einem Problem, wenn wir Antibiotika einnehmen, da die guten Bakterien im Darm zusammen mit denen, die eine Infektion verursachen, abgetötet werden, und da C. diff resistent ist, kann es wachsen und Krankheiten verursachen, die von Durchfall bis zum Tod durch massive Läsionen im Darm reichen. Ein weiteres Problem ist die Tatsache, dass die einzige Möglichkeit zur Behandlung von C.diff. in der Einnahme von Antibiotika besteht, so dass der Kreislauf von neuem beginnt und viele Menschen wiederkehrende Infektionen bekommen.
Die Bestimmung der Struktur bietet die Möglichkeit, C.diff-spezifische Medikamente zu entwickeln, die die S-Schicht, das Kettenhemd, durchbrechen und Löcher schaffen, durch die Moleküle eindringen und die Zelle abtöten können.
Die Elektronenkristallographie wurde von den Kollegen Dr. Rob Fagan und Professor Per Bullough von der Universität Sheffield durchgeführt.
Dr. Fagan sagte: "Wir untersuchen nun, wie unsere Erkenntnisse genutzt werden könnten, um neue Wege zur Behandlung von C. diff-Infektionen zu finden, z. B. durch den Einsatz von Bakteriophagen, die sich an C. diff-Zellen anlagern und diese abtöten - eine vielversprechende potenzielle Alternative zu herkömmlichen Antibiotika."
Aus dem Team von Dr. Salgado an der Universität Newcastle haben die Doktorandin Paola Lanzoni-Mangutchi und Dr. Anna Barwinska-Sendra die strukturellen und funktionellen Details der Bausteine entschlüsselt und die gesamte Röntgenkristallstruktur von SlpA bestimmt. Paola sagte: "Dies war ein anspruchsvolles Projekt, und wir haben viele Stunden damit verbracht, den schwierigenKäfer zu kultivieren und Röntgendaten am Diamond Light Source Synchrotron zu sammeln."
Dr. Barwinska-Sendra fügte hinzu: "Die Zusammenarbeit war der Schlüssel zu unserem Erfolg, es ist sehr aufregend, Teil dieses Teams zu sein und endlich unsere Arbeit teilen zu können."
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.