Reichlich vorhandene 'Geheimtüren' in menschlichen Proteinen könnten die Arzneimittelforschung neu gestalten
Identifizierung versteckter Schwachstellen auf der Oberfläche von 'unbehandelbaren' Proteinen könnte die Behandlung von Krankheiten verändern
Die Zahl der potenziellen therapeutischen Ziele auf den Oberflächen menschlicher Proteine ist viel größer als bisher angenommen, so die Ergebnisse einer neuen Studie, die in der Zeitschrift Nature veröffentlicht wurde.
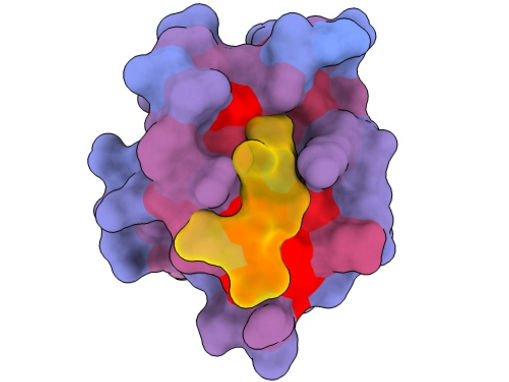
Ein dreidimensionales Bild, das das menschliche Protein PSD95-PDZ3 aus verschiedenen Blickwinkeln zeigt. Dargestellt ist der Bindungspartner CRIPT (gelb) im aktiven Zentrum, wobei der Farbverlauf von blau nach rot ein zunehmendes Potenzial für allosterische Effekte anzeigt. Basierend auf dem PDB-Zugang 1BE9.
André Faure/CRG
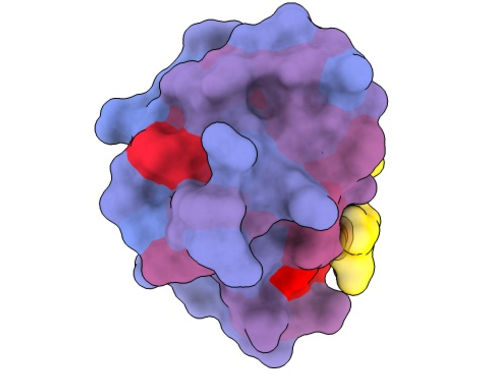
Ein dreidimensionales Bild, das das menschliche Protein PSD95-PDZ3 aus verschiedenen Blickwinkeln zeigt. Dargestellt ist der Bindungspartner CRIPT (gelb) im aktiven Zentrum, wobei der Farbverlauf von blau nach rot ein zunehmendes Potenzial für allosterische Effekte anzeigt. Basierend auf dem PDB-Zugang 1BE9.
André Faure/CRG
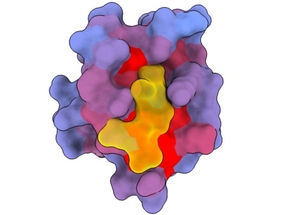
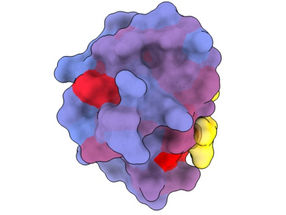
Eine bahnbrechende neue Technik, die von Forschern des Zentrums für Genomische Regulierung (CRG) in Barcelona entwickelt wurde, hat die Existenz einer Vielzahl bisher geheimer Türen aufgedeckt, die die Funktion von Proteinen steuern und die theoretisch angegangen werden könnten, um den Verlauf so unterschiedlicher Krankheiten wie Demenz, Krebs und Infektionskrankheiten drastisch zu verändern.
Mit Hilfe der Methode, bei der Zehntausende von Experimenten gleichzeitig durchgeführt werden, wurde erstmals eine Karte dieser schwer fassbaren Ziele, die auch als allosterische Stellen bezeichnet werden, in zwei der am häufigsten vorkommenden menschlichen Proteine erstellt, wobei sich herausstellte, dass diese reichlich vorhanden und identifizierbar sind.
Dieser Ansatz könnte die Arzneimittelforschung grundlegend verändern und zu sichereren, intelligenteren und wirksameren Medikamenten führen. Es ermöglicht Forschungslabors auf der ganzen Welt, Schwachstellen in beliebigen Proteinen zu finden und auszunutzen - auch in solchen, die bisher als "unbehandelbar" galten.
"Diese potenziellen therapeutischen Schwachstellen sind nicht nur zahlreich vorhanden, sondern lassen sich nachweislich auch auf viele verschiedene Arten manipulieren. Anstatt sie einfach an- oder auszuschalten, könnten wir ihre Aktivität wie einen Thermostat modulieren. Aus technischer Sicht ist das ein echter Glücksfall, denn es gibt uns viel Spielraum für die Entwicklung von 'intelligenten Medikamenten', die auf das Schlechte abzielen und das Gute verschonen", erklärt André Faure, Postdoktorand am CRG und Mitautor der Studie.
Proteine spielen eine zentrale Rolle in allen lebenden Organismen und erfüllen lebenswichtige Funktionen, wie die Bereitstellung von Strukturen, die Beschleunigung von Reaktionen, die Funktion als Botenstoffe oder die Bekämpfung von Krankheiten. Sie bestehen aus Aminosäuren, die sich im dreidimensionalen Raum zu unzähligen verschiedenen Formen falten. Die Form eines Proteins ist ausschlaggebend für seine Funktion, und ein einziger Fehler in einer Aminosäuresequenz kann verheerende Folgen für die menschliche Gesundheit haben.
Die Allosterie ist eines der großen ungelösten Rätsel der Proteinfunktion. Allosterische Effekte treten auf, wenn ein Molekül an die Oberfläche eines Proteins bindet, was wiederum Veränderungen an einer entfernten Stelle desselben Proteins hervorruft und dessen Funktion ferngesteuert reguliert. Viele krankheitsverursachende Mutationen, darunter zahlreiche Krebstreiber, sind aufgrund ihrer allosterischen Wirkungen pathologisch.
Trotz ihrer grundlegenden Bedeutung sind allosterische Stellen unglaublich schwer zu finden. Das liegt daran, dass die Regeln, nach denen Proteine auf atomarer Ebene funktionieren, nicht sichtbar sind. Ein Protein kann sich beispielsweise in Gegenwart eines eintreffenden Moleküls umformen und dabei tief in seiner Oberfläche verborgene Taschen freilegen, die potenziell allosterisch wirken, aber mit der herkömmlichen Strukturbestimmung allein nicht identifizierbar sind.
Bisher haben Arzneimitteljäger Behandlungen entwickelt, die auf die aktive Stelle eines Proteins abzielen, d. h. auf den kleinen Bereich, in dem chemische Reaktionen stattfinden oder Ziele gebunden werden. Der Nachteil dieser Medikamente, die auch als orthosterische Medikamente bezeichnet werden, besteht darin, dass die aktiven Stellen vieler Proteine sehr ähnlich aussehen, so dass die Medikamente dazu neigen, viele verschiedene Proteine auf einmal zu binden und zu hemmen, was zu möglichen Nebenwirkungen führt. Im Vergleich dazu bedeutet die Spezifität allosterischer Wirkorte, dass allosterische Arzneimittel zu den wirksamsten derzeit verfügbaren Medikamenten gehören. Viele allosterische Medikamente, die zur Behandlung verschiedener Krankheiten von Krebs über AIDS bis hin zu Hormonstörungen eingesetzt werden, wurden durch Zufall entdeckt.
Die Autoren der Studie gingen diese Herausforderung an, indem sie eine Technik namens Double Deep PCA (ddPCA) entwickelten, die sie als "Brute-Force-Experiment" beschreiben. "Wir brechen Dinge absichtlich auf tausende verschiedene Arten, um uns ein vollständiges Bild davon zu machen, wie etwas funktioniert", erklärt ICREA-Forschungsprofessor Ben Lehner, Koordinator des Programms Systembiologie am CRG und Autor der Studie. "Das ist so, als ob man eine defekte Zündkerze vermutet, aber anstatt nur diese zu überprüfen, zerlegt der Mechaniker das ganze Auto und überprüft es Stück für Stück. Indem wir zehntausend Dinge auf einmal testen, identifizieren wir alle Teile, die wirklich wichtig sind."
Die Methode funktioniert, indem die Aminosäuren, aus denen ein Protein besteht, verändert werden, was zu Tausenden von verschiedenen Versionen des Proteins mit nur einem oder zwei Unterschieden in der Sequenz führt. Die Auswirkungen der Mutationen werden dann alle gleichzeitig in lebenden Zellen im Labor getestet.
"Jede Zelle ist eine winzige Fabrik, die eine andere Version des Proteins herstellt. In einem einzigen Reagenzglas haben wir Millionen von verschiedenen Fabriken und können so sehr schnell testen, wie gut alle verschiedenen Versionen eines Proteins funktionieren", fügt Dr. Lehner hinzu. Die bei den Experimenten gesammelten Daten werden in neuronale Netze eingespeist, Algorithmen, die die Daten nach dem Vorbild des menschlichen Gehirns analysieren und so umfassende Karten erstellen, die die Lage der allosterischen Stellen auf der Oberfläche der Proteine genau bestimmen.
Einer der großen Vorteile der Methode besteht darin, dass es sich um eine erschwingliche Technik handelt, die jedem Forschungslabor auf der ganzen Welt zugänglich ist. "Sie vereinfacht den Prozess, der für die Suche nach allosterischen Stellen erforderlich ist, erheblich, wobei die Technik genauer arbeitet als verschiedene teurere und zeitaufwändigere Labormethoden", sagt Júlia Domingo, Mitautorin der Studie. "Wir hoffen, dass andere Wissenschaftler diese Technik nutzen, um die allosterischen Stellen menschlicher Proteine schnell und umfassend zu kartieren."
Einer der längerfristigen Vorteile dieser Technik ist ihr Potenzial zur Untersuchung der Funktion und der Evolution von Proteinen. Die Autoren der Studie glauben, dass die Methode, wenn sie in größerem Umfang eingesetzt wird, eines Tages zu Fortschritten führen könnte, die die Eigenschaften von Proteinen anhand ihrer Aminosäuresequenzen genau vorhersagen können. Im Erfolgsfall, so argumentieren die Autoren, würde dies eine neue Ära der prädiktiven Molekularbiologie einläuten und eine viel schnellere Entwicklung neuer Medikamente und einer sauberen, biologiebasierten Industrie ermöglichen.
"Während einige Werkzeuge die Struktur eines Proteins durch Lesen seiner Sequenz vorhersagen können, geht unsere Methode einen Schritt weiter, indem sie uns sagt, wie ein Protein funktioniert. Dies ist Teil einer größeren Vision, die Biologie so ingenieurmäßig zu gestalten wie Flugzeuge, Brücken oder Computer. Wir stehen seit über 70 Jahren vor denselben Herausforderungen, aber es stellt sich heraus, dass sie leichter zu bewältigen sind, als wir bisher dachten. Wenn wir Erfolg haben, eröffnet sich ein neues Feld mit noch nie dagewesenen Möglichkeiten", so Dr. Lehner abschließend.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.