Kristallstudie könnte DNA-Rätsel aufklären
Rice-Labor erfasst ungesehene Details der Replikation, Hinweise darauf, wie Mutationen entstehen können
Wenn sich Zellen vermehren, machen die internen Mechanismen, die die DNA kopieren, fast immer alles richtig. Biowissenschaftler der Rice University haben ein winziges Detail aufgedeckt, das hilft zu verstehen, wie der Prozess schief gehen kann.
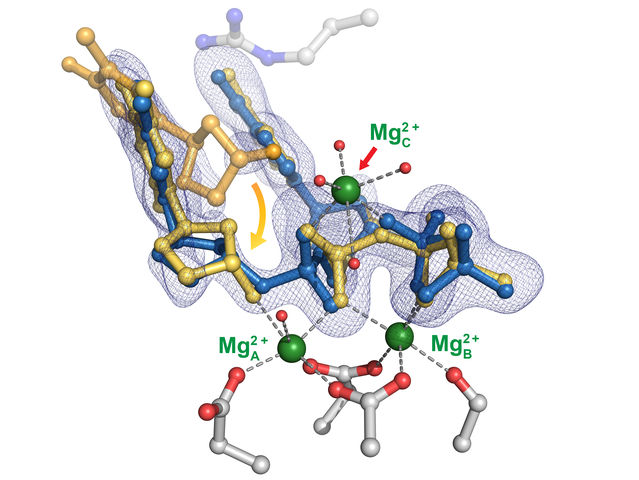
Die Struktur von Poly-eta, einem Enzym, das zur Steuerung der DNA-Replikation beiträgt. Eine zeitaufgelöste kristallographische Studie des Enzyms an der Rice University hat die Bedeutung eines dritten Metallions aufgedeckt, das zur Stabilisierung des Prozesses beiträgt und die Genauigkeit gewährleistet.
Yang Gao Lab/Rice University
Ihre Untersuchung von Enzymen ergab, dass das Vorhandensein eines zentralen Metallions, das für die DNA-Replikation von entscheidender Bedeutung ist, auch bei Fehlinkorporationen, d. h. der fehlerhaften Anordnung von Nukleotiden auf neuen Strängen, eine Rolle zu spielen scheint.
Die in Nature Communications veröffentlichte Beobachtung könnte dazu beitragen, Behandlungen für genetische Mutationen und die von ihnen verursachten Krankheiten, einschließlich Krebs, zu finden.
Der Rice-Strukturbiologe Yang Gao, der Doktorand Caleb Chang und die ehemalige Studentin Christie Lee Luo analysierten mit Hilfe der zeitaufgelösten Kristallographie die flexiblen Enzyme, die Polymerase genannt werden, wie sie sich biegen und verdrehen, um aus einem Pool von C-, G-, A- und T-Nukleotiden schnell wieder komplette DNA-Stränge zusammenzusetzen.
Alle an der DNA-Replikation beteiligten Proteine sind auf Metallionen - entweder Magnesium oder Mangan - angewiesen, um den Transfer der Nukleotide an ihre richtige Position entlang des Strangs zu katalysieren. Aber ob zwei oder drei Ionen beteiligt sind, war lange Zeit ein Streitpunkt.
Das Rice-Team scheint diese Frage geklärt zu haben, indem es eine als eta bekannte Polymerase untersuchte, ein Enzym für die Translesionssynthese, das vor ultraviolett-induzierten Läsionen schützt. Menschen mit Mutationen im Poly-eta-Gen haben den Forschern zufolge häufig eine Veranlagung für Xeroderma pigmentosum und Hautkrebs.
Gao sagte, dass typische Polymerasen einer rechtshändigen Form ähneln, und er stellt sie sich wie eine echte Hand vor: "Sie haben eine Handflächendomäne, die die aktive Stelle enthält, eine Fingerdomäne, die sich schließt, um mit dem neuen Basenpaar zu interagieren, und eine Daumendomäne, die den Primer/die DNA-Vorlage bindet", sagte er.
Bislang konnten die Wissenschaftler jedoch nur einige Details des gut versteckten Mechanismus erahnen, mit dem die Polymerasen ihre Arbeit verrichten und gelegentlich versagen. Die Art der zeitaufgelösten Kristallographie, die in Gaos Labor verwendet wurde, ermöglichte es den Forschern, Proteine zu analysieren, die in 34 Zwischenstadien kristallisiert wurden, um die Positionen ihrer Atome vor, während und nach der DNA-Synthese zu bestimmen.
"Diese kinetische Reaktion ist schwer zu erfassen, weil es viele Atome gibt und sie sehr schnell arbeiten", sagte Gao, ein Assistenzprofessor für Biowissenschaften, der seit 2019 als CPRIT-Stipendiat an der Universität Rice arbeitet. "Wir haben nie gewusst, wie sich die Atome zusammen bewegen, weil die räumliche Information fehlte. Durch das Einfrieren der Proteine und eines kleinen Substratmoleküls konnten wir diese katalytische Reaktion zum ersten Mal erfassen."
Die Studie führte zu der Theorie, dass das erste der drei Metallatome in eta die Nukleotidbindung unterstützt und das zweite der Schlüssel ist, um das Nukleotid und den Primer in der Spur zu halten, indem es die Bindung loser Nukleotide an den Primer stabilisiert, der sich auf der bestehenden Hälfte des neuen Strangs (auch Substrat genannt) befindet. Primer sind kurze DNA-Stränge, die markieren, wo die Polymerasen mit der Aneinanderreihung neuer Nukleotide beginnen.
"Nur wenn die ersten beiden Metallionen in Schach gehalten werden, kann das dritte kommen und die Reaktion in Gang setzen", so Chang, was darauf hindeutet, dass der Prozess bei allen Polymerasen gleich ist.
Die Forscher stellten auch fest, dass Poly-eta ein Motiv enthält, das es anfällig für eine falsche Ausrichtung der Primer macht, was zu einer größeren Wahrscheinlichkeit eines Fehleinbaus führt.
"Hier geht es zunächst um einen grundlegenden Mechanismus des Lebens", so Gao. "Die DNA muss genau kopiert werden, und Fehler können zu menschlichen Krankheiten führen. Menschen, die diese Enzyme studieren, wissen, dass sie bei der DNA-Synthese immer viel, viel besser abschneiden, als sie sollten, weil ihnen nur eine sehr begrenzte Menge an Energie zur Verfügung steht, um das richtige Basenpaar zu wählen."
Für Gao liegt der eigentliche Gewinn darin, dass er die Fähigkeit der zeitaufgelösten Kristallographie unter Beweis gestellt hat, einen gesamten katalytischen Prozess im atomaren Detail zu beobachten.
"Dadurch können wir genau sehen, was in einem dynamischen katalytischen Prozess im Laufe der Zeit passiert", sagte er.
Hinweis: Dieser Artikel wurde mit einem Computersystem ohne menschlichen Eingriff übersetzt. LUMITOS bietet diese automatischen Übersetzungen an, um eine größere Bandbreite an aktuellen Nachrichten zu präsentieren. Da dieser Artikel mit automatischer Übersetzung übersetzt wurde, ist es möglich, dass er Fehler im Vokabular, in der Syntax oder in der Grammatik enthält. Den ursprünglichen Artikel in Englisch finden Sie hier.
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Proteinanalytik
Die Proteinanalytik ermöglicht einen tiefen Einblick in diese komplexen Makromoleküle, ihre Struktur, Funktion und Wechselwirkungen. Sie ist unerlässlich für die Entdeckung und Entwicklung von Biopharmazeutika, das Verständnis von Krankheitsmechanismen und die Identifizierung von therapeutischen Zielen. Durch Techniken wie Massenspektrometrie, Western Blot und Immunoassays können Forscher Proteine auf molekularer Ebene charakterisieren, ihre Konzentration bestimmen und mögliche Modifikationen identifizieren.

Themenwelt Proteinanalytik
Die Proteinanalytik ermöglicht einen tiefen Einblick in diese komplexen Makromoleküle, ihre Struktur, Funktion und Wechselwirkungen. Sie ist unerlässlich für die Entdeckung und Entwicklung von Biopharmazeutika, das Verständnis von Krankheitsmechanismen und die Identifizierung von therapeutischen Zielen. Durch Techniken wie Massenspektrometrie, Western Blot und Immunoassays können Forscher Proteine auf molekularer Ebene charakterisieren, ihre Konzentration bestimmen und mögliche Modifikationen identifizieren.
























































