Fluoreszenzmikroskopie mit Ångström-Auflösung
Diese Innovation wird einen Paradigmenwechsel bei der Untersuchung biologischer Systeme mit bisher unerreichter Detailgenauigkeit einleiten
Der Forschungsgruppe um Ralf Jungmann am Max-Planck-Institut für Biochemie (MPIB) und der Ludwig-Maximilians-Universität (LMU) München ist ein Durchbruch in der Fluoreszenzmikroskopie gelungen. Das Team entwickelte „Resolution Enhancement by Sequential Imaging“ (RESI), eine revolutionäre Technik, die die Auflösung der Fluoreszenzmikroskopie bis auf die Ångströmskala verbessert. Diese Innovation wird einen Paradigmenwechsel bei der Untersuchung biologischer Systeme mit bisher unerreichter Detailgenauigkeit einleiten.
Zellen, die grundlegenden Einheiten des Lebens, enthalten eine Vielzahl komplexer Strukturen, Prozesse und Mechanismen, die lebende Systeme aufrechterhalten und fortbestehen lassen. Viele zelluläre Kernelemente wie DNA, RNA, Proteine und Lipide sind nur wenige Nanometer groß. Dies macht sie erheblich kleiner als die Auflösungsgrenze der herkömmlichen Lichtmikroskopie. Die genaue Zusammensetzung und Anordnung dieser Moleküle und Strukturen ist daher oft unbekannt, was zu einem mangelnden mechanistischen Verständnis grundlegender Aspekte der Biologie führt.
In den letzten Jahren haben sogenannte Superauflösungstechniken enorme Fortschritte gemacht und erlauben es, subzelluläre Strukturen unterhalb der klassischen Beugungsgrenze des Lichts aufzulösen. Die Einzelmoleküllokalisierungsmikroskopie („Single-Molecule Localization Microscopy“, SMLM) ist ein Verfahren, mit dem Strukturen in der Größenordnung von zehn Nanometern aufgelöst werden können, indem ihre individuellen Fluoreszenzemissionen zeitlich getrennt werden. Da einzelne Zielmoleküle in einem sonst dunklen Sichtfeld stochastisch aufleuchten (sie blinken), können ihre Positionen mit einer Genauigkeit unterhalb der Beugungsgrenze bestimmt werden. DNA-PAINT, erfunden von der Jungmann-Gruppe, ist eine SMLM-Technik, die temporäres Hybridisieren von Farbstoff-markierten DNA-"Imager"-Strängen nutzt, um das notwendige Blinken für Superauflösung zu erreichen. Bislang war jedoch selbst DNA-PAINT nicht in der Lage, die kleinsten zellulären Strukturen aufzulösen.
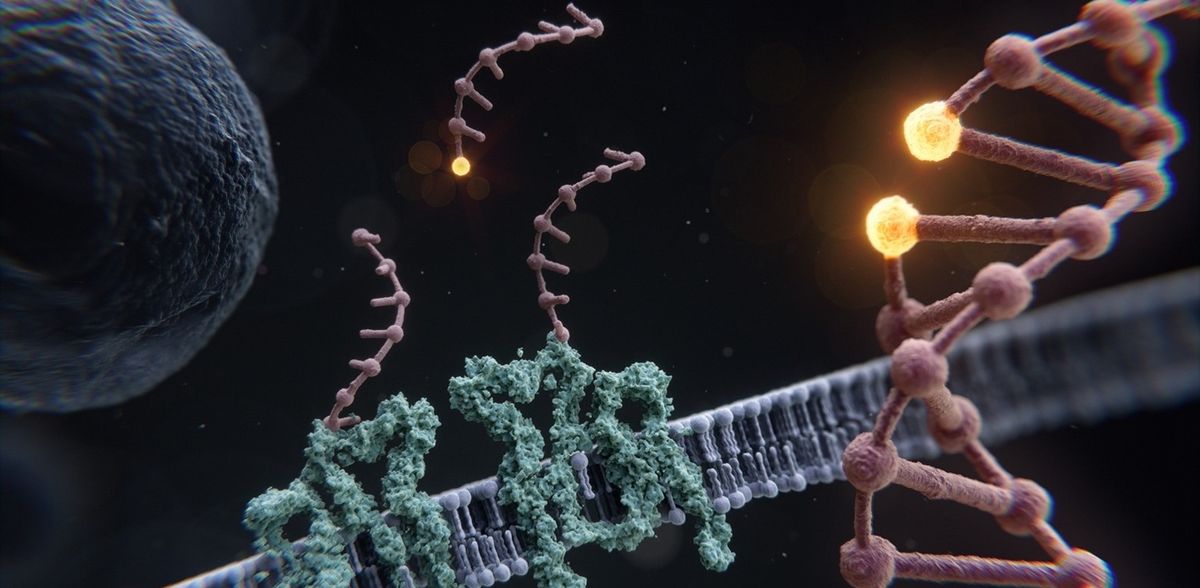
In der aktuellen Studie, die von den Erstautoren Susanne Reinhardt, Luciano Masullo, Isabelle Baudrexel und Philipp Steen zusammen mit Jungmann geleitet wurde, stellt das Team einen neuen Ansatz in der Superauflösungsmikroskopie vor, der eine grundsätzlich "unbegrenzte" räumliche Auflösung ermöglicht. Die neue Technik mit der Bezeichnung "Resolution Enhancement by Sequential Imaging", kurz RESI, nutzt die Fähigkeit von DNA-PAINT, die Identität von Zielobjekten durch eindeutige DNA-Sequenzen zu kodieren. Nahe aneinanderlegende Moleküle, die mit klassischer SMLM nicht aufgelöst werden können, werden durch unterschiedliche DNA-Sequenzen markiert. Dadurch entsteht ein zusätzliches Unterscheidungsmerkmal. Durch sequenzielle Bildgebung erst einer und dann der anderen Sequenz (und damit Molekül), können sie nun eindeutig getrennt und aufgelöst werden. Da sie nacheinander abgebildet werden, können die Ziele beliebig nahe beieinander liegen, was mit keiner anderen Technik möglich ist. Darüber hinaus erfordert RESI keine spezialisierten Mikroskope, es kann mit jedem Standard-Fluoreszenzmikroskop angewendet werden, was es für fast alle Forschende leicht zugänglich macht.
Um die Auflösungsverbesserung von RESI zu demonstrieren, stellte sich das Team der Herausforderung, einen der kleinsten räumlichen Abstände in einem biologischen System aufzulösen: Den Abstand zwischen einzelnen Basen entlang einer DNA-Doppelhelix, die weniger als einen Nanometer (ein Milliardstel Meter) voneinander entfernt sind. In einer DNA-Origami-Nanostruktur, die einzelsträngige DNA-Sequenzen in einem Abstand von nur einem Basenpaar enthielt, konnte das Forscherteam einen Abstand von 0,85 nm (oder 8,5 Ångström) zwischen benachbarten Basen auflösen. Den Forschenden gelang diese Messung mit einer Präzision von 1 Ångström, oder einem Zehnmilliardstel Meter, was die beispiellosen Möglichkeiten des RESI-Verfahrens unterstreicht.
Wichtig ist, dass die Technik universell und nicht nur auf Anwendungen in DNA-Nanostrukturen beschränkt ist. Zu diesem Zweck untersuchte das Team den molekularen Wirkmechanismus von Rituximab, einem Anti-CD20 monoklonalen Antikörper, der erstmals 1997 zur Behandlung von CD20-positivem Blutkrebs zugelassen wurde. Die Untersuchung der Auswirkungen solcher Medikamentenmoleküle auf molekulare Rezeptormuster übersteigt jedoch die räumliche Auflösung herkömmlicher Mikroskopietechniken. Zu verstehen, ob und wie sich solche Muster im Krankheitsfall sowie bei einer Behandlung verändern, ist nicht nur für die mechanistische Grundlagenforschung, sondern auch für die Entwicklung neuer zielgerichteter Krankheitstherapien von großer Bedeutung. Mit RESI konnten Jungmann und sein Team die natürliche Anordnung von CD20-Rezeptoren in unbehandelten Zellen als Dimere offenlegen und aufdecken, wie sich CD20 bei Medikamentenbehandlung zu Ketten von Dimeren umorganisierte. Die Erkenntnisse auf der Einzelproteinebene helfen nun, die molekulare Wirkweise von Rituximab besser zu verstehen.
Da RESI in ganzen, intakten Zellen durchgeführt wird, schließt die Technik die Lücke zwischen rein strukturellen Methoden wie Röntgenkristallographie oder kryogener Elektronenmikroskopie und herkömmlichen bildgebenden Verfahren mit geringerer Auflösung für ganze Zellen. Jungmann und sein Team sind überzeugt: "Diese beispiellose Technik nicht nur für Superauflösung, sondern auch für die biologische Forschung insgesamt ein echter Game-Changer."
Originalveröffentlichung
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Fluoreszenzmikroskopie
Die Fluoreszenzmikroskopie hat die Life Sciences, Biotechnologie und Pharmazie revolutioniert. Mit ihrer Fähigkeit, spezifische Moleküle und Strukturen in Zellen und Geweben durch fluoreszierende Marker sichtbar zu machen, bietet sie einzigartige Einblicke auf molekularer und zellulärer Ebene. Durch ihre hohe Sensitivität und Auflösung erleichtert die Fluoreszenzmikroskopie das Verständnis komplexer biologischer Prozesse und treibt Innovationen in Therapie und Diagnostik voran.

Themenwelt Fluoreszenzmikroskopie
Die Fluoreszenzmikroskopie hat die Life Sciences, Biotechnologie und Pharmazie revolutioniert. Mit ihrer Fähigkeit, spezifische Moleküle und Strukturen in Zellen und Geweben durch fluoreszierende Marker sichtbar zu machen, bietet sie einzigartige Einblicke auf molekularer und zellulärer Ebene. Durch ihre hohe Sensitivität und Auflösung erleichtert die Fluoreszenzmikroskopie das Verständnis komplexer biologischer Prozesse und treibt Innovationen in Therapie und Diagnostik voran.