Antibakterielle Nanomaterialien: Aktive Zentren bei Wasserdesinfektion sichtbar gemacht
Fluoreszenzlebensdauer-Mikroskopie hat großes Potenzial, um die Effektivität antibakterieller Nanomaterialien gezielt zu steigern
Neue Methoden im Kampf gegen Bakterien sind gefragter denn je. Ein vielversprechender Weg führt über Nanomaterialien, die unter Lichteinfluss Sauerstoffradikale freisetzen und Mikroorganismen gezielt abtöten. Eine Herausforderung bei der Entwicklung solcher Materialien besteht jedoch darin, die auf molekularer Ebene beobachteten Eigenschaften auf das gesamte Material zu übertragen. Mehr Licht ins Dunkel bringt nun eine Studie der Universität Duisburg-Essen in der Fachzeitschrift Angewandte Chemie: Das Team um Juniorprofessorin Dr. Anzhela Galstyan machte erstmals die aktiven Zentren im Fluoreszenzlebensdauer-Mikroskop sichtbar und stellt so Zusammenhänge zwischen Aktivität und Materialeigenschaften her.
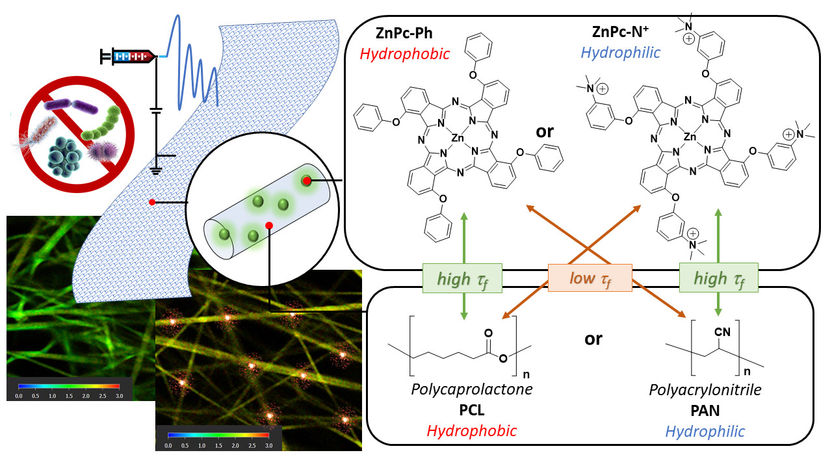
links unten: Die FLIM-Aufnahmen zeigen den Unterschied zwischen einer aktiven und einer inaktiven Membran. In der aktiven Membran markieren die roten Bereiche aktive Stellen, an denen der Photosensibilisator (PS) in einem angeregten Zustand verbleibt, was auf eine hohe Aktivität hinweist. Rechts im Bild: Schematische Darstellung der antibakteriellen Membran mit den chemischen Strukturen der verwendeten (PS) und Polymere.
Universität Duisburg-Essen
Bakterien können auch ohne herkömmliche Antibiotika bekämpft werden. Eine Möglichkeit ist die photodynamische Inaktivierung. Hierbei werden spezielle lichtempfindliche Moleküle, sogenannte Photosensibilisatoren, durch Bestrahlung mit Licht aktiviert. Diese bilden Sauerstoffradikale, die Bakterien abtöten, indem sie deren Proteine, DNA und Teile der Zellwände angreifen.
„Wir nutzen dieses Wirkprinzip und integrieren photoaktive Moleküle in Nanofasermembranen, um sie für die Wasseraufbereitung einzusetzen“, erläutert Prof. Dr. Galstyan. Doch molekular hochaktive Photosensibilisatoren führen nicht automatisch zu einem ebenso leistungsstarken Membranmaterial. Das Team um Galstyan setzte daher die Fluoreszenzlebensdauer-Mikroskopie (FLIM) ein, um die Verteilung der Photosensibilisatoren innerhalb antibakterieller Nanomembranen sichtbar zu machen. Die Fluoreszenzlebensdauer beschreibt jene Zeitspanne, in der lichtempfindliche Moleküle nach der Aktivierung angeregt bleiben – ein Indikator, der auf die Menge der gebildeten Sauerstoffradikale schließen lässt.
Bei der Analyse der FLIM-Bilder stellten die Forschenden fest, dass sich die Verteilung der Sensibilisatoren in den untersuchten Nanofasern deutlich unterscheidet. Für die Studie wurden Membranen auf Polymerbasis mittels Elektrospinnverfahren entwickelt, die unterschiedliche Oberflächeneigenschaften (hydrophob und hydrophil) kombinierten. „Die höchste antibakterielle Aktivität haben wir in einer Nanofaser beobachtet, in der das hydrophile, wasserliebende ZnPc−N+ als Photosensibilisator integriert wurde“, berichtet Galstyan.
Die FLIM-Aufnahmen erklären die Beobachtung: „An der Grenzfläche zwischen Wasser und Membran findet sich eine hohe Dichte an aktiven Zentren mit verlängerter Lebensdauer. Die hydrophilen Photosensibilisatoren tendieren dazu, sich zur wasserliebenden Phase hin auszurichten und lagern sich bevorzugt an der Material-Wasser-Grenzfläche an“, so die Chemikerin.
„Dank der FLIM-Bildgebung können wir nicht nur die Position der aktiven Zentren innerhalb der Nanofasern identifizieren, sondern auch den direkten Zusammenhang zwischen Materialstruktur und antibakterieller Aktivität herstellen“, fasst Galstyan zusammen. Für die zukünftige Entwicklung antibakterieller Nanomaterialien sieht sie in der Fluoreszenzlebensdauer-Mikroskopie großes Potenzial, um die Effektivität solcher Materialien gezielt zu steigern.
Originalveröffentlichung
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Fluoreszenzmikroskopie
Die Fluoreszenzmikroskopie hat die Life Sciences, Biotechnologie und Pharmazie revolutioniert. Mit ihrer Fähigkeit, spezifische Moleküle und Strukturen in Zellen und Geweben durch fluoreszierende Marker sichtbar zu machen, bietet sie einzigartige Einblicke auf molekularer und zellulärer Ebene. Durch ihre hohe Sensitivität und Auflösung erleichtert die Fluoreszenzmikroskopie das Verständnis komplexer biologischer Prozesse und treibt Innovationen in Therapie und Diagnostik voran.

Themenwelt Fluoreszenzmikroskopie
Die Fluoreszenzmikroskopie hat die Life Sciences, Biotechnologie und Pharmazie revolutioniert. Mit ihrer Fähigkeit, spezifische Moleküle und Strukturen in Zellen und Geweben durch fluoreszierende Marker sichtbar zu machen, bietet sie einzigartige Einblicke auf molekularer und zellulärer Ebene. Durch ihre hohe Sensitivität und Auflösung erleichtert die Fluoreszenzmikroskopie das Verständnis komplexer biologischer Prozesse und treibt Innovationen in Therapie und Diagnostik voran.























































